La cancérisation et mutations génétiques

Gènes et cancer...
QUELQUES NOTIONS DE BASE
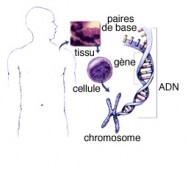
L’ADN (Acide Déoxyribo Nucléique)
Cette molécule est contenue dans les chromosomes (corps "colorés") découvert en 1879 par un chercheur allemand, Walther Flemming (1843 - 1905), pionnier de la cytogénétique. Il a décrit, à la suite de Carl Nägeli (1817 - 1891), botaniste suisse, les phase de la division cellulaire..
Chez l’homme, il existe 22 paires de chromosomes plus une paire qui détermine le sexe (46,XY pour les hommes et 46,XX pour les femmes).
Le matériel génétique d’un être vivant ou génome est emmagasiné dans une molécule appelée Acide Désoxyribonucléique (ADN). L’ADN est formé d’une succession de bases nucléotidiques organisées dans un ordre bien précis. C’est un code universel pour la production de toutes les protéines.
L'ADN est le support des informations génétiques nécessaires pour la transmission de cette information lors de la division cellulaire, c'est l'hérédité et l'activité métabolique de chaque cellule, c'est-à-dire la synthèse de protéines.
La molécule d'ADN
Elle est constituée de deux chaînes linéaires de molécules assemblées sous forme d'hélice. Déroulé, l'ADN mesurerait 1 mètre.
Chaque chaîne comprend une suite ininterrompue de bases pyrimidiques ou puriques. Ces bases sont dénommées par leurs initiales A, C, G et T. C'est cette suite de bases qui compose le code génétique. Ces bases sont complémentaires et elles s'apparient toujours de la même façon : A avec T et C avec G.
Lorsqu'un certain nombre de lettres est assemblé, cet ensemble forme un mot. Celui-ci va permettre une fonction de la cellule, comme par exemple la production d'une protéine.
UN GÈNE
Cette suite précise de bases qui aboutit à un mot ayant une fonction, s'appelle un gène. Le gène est donc le déterminant héréditaire d'une caractéristique comme la couleur des yeux, le groupe sanguin, par exemple.
LE GÉNOME
C’est l’ensemble des informations contenues par les gènes d’une cellule.
Le génome humain contient plus de 20 000 gènes codant des protéines, mais chaque type cellulaire n’en exprime qu’un sous-ensemble. Ainsi, certains gènes exprimés dans les neurones sont silencieux dans les cellules musculaires, et vice versa.
Différentes régulations contrôlant l’expression des gènes sont de nature épigénétique, c’est-à-dire qu’elles modulent l’activité du génome sans modifier sa séquence et se transmettent à leur descendance
GÉNOTYPE ET PHÉNOTYPE
Le terme maladie des gènes n’est pas synonyme de maladie génétique, au sens habituel car c’est le risque qui est transmissible et non le cancer lui-même.
Par ailleurs, si ce sont les gènes qui sont porteurs de l’altération initiale, ce sont les protéines qui en sont issues, après transcription et traduction, qui sont porteuses des propriétés pathologiques, caractérisant le phénotype cancéreux. Ces protéines anormales sont désignées par le terme d’oncoprotéines.
D’un point de vue biologique, le cancer est la conséquence d'une accumulation d'altérations du génome cellulaire, ou de sa transcription cytoplasmique, certaines permettant l'autonomie de la division, d'autres l'invasion locale, l’angiogenèse ou la diffusion métastatique, puis éventuellement la résistance aux drogues.
LES ERREURS POSSIBLES
Tout au long de la vie, les cellules se divisent pour se reproduire à l'identique et remplacer les cellules qui meurent. Chaque fois que la cellule se divise, elle doit recopier la totalité des 3 milliards de bases A, C, G et T.
Les cellules peuvent faire des erreurs en recopiant la chaîne ADN. Il peut s'agir, par exemple :
- De mutations : A T GGC devenant A A GGC
- De délétions : AT GGCC TGG devenant après la perte de GGCC , ATTGG
- D'insertions : ATGGC devenant après insertion de AAA , AT AAA GGC
- De translocations, par exemple entre le chromosome 9 et le chromosome 22, t (9;22)
Ces modifications peuvent être héréditaires ou acquises.
Elles peuvent entraîner des altérations des protéine à l'origine soit d'une augmentation soit d'une diminution d'activité, qu'elle soit normale ou pathologique. Par exemple, si une erreur de transcription est faite dans un gène qui prévient le cancer, ou gène suppresseur de tumeur, la personne aura un risque accru de développer un cancer.
LE CANCER : UNE MALADIE DES GÈNES...
UNE MALADIE "GENETIQUE"...
Les cancers peuvent être considérés comme, avant tout, des maladies particulières des gènes.
Ces altérations des gènes peuvent être congénitales, c’est-à-dire, transmises à la naissance par hérédité ou, le plus souvent, acquises, c’est-à-dire se développant après la naissance.
UNE OU PLUSIEURS MUTATIONS ?
Les chercheurs ont tendance à diviser les cancers en deux grands groupes principaux en fonction du nombre d’altérations génétiques.
Les tumeurs pauci-génétiques (pauci = peu)
Ces tumeurs présentent une ou très peu d’anomalies génétiques.
Les accidents génétiques apparaissent tôt dans la vie. Ils sont "bruyants" car responsables de tumeurs à temps de prolifération rapide.
C’est le cas du rétinoblastome qui une tumeur maligne de la rétine de l’enfant, de certains cancers de l’enfant et de la plupart des leucémies aiguës.
Les tumeurs à oncogenèse complexe
Ce sont les plus fréquentes. Les anomalies observées concernent tous les aspects du vivant :
- Les mécanismes hérités du vivant unicellulaire
- Le contrôle du cycle cellulaire
- La réparation de l’ADN
- La résistance aux xénobiotiques
- Les mécanismes acquis par les organismes plus élaborés
- Les processus d’intégration de l’information
- La réponse aux hormones et aux facteurs de croissance
- La réponse adaptative aux modifications du micro-environnement
- Les communications intercellulaires
- L’acquisition de fonctions biologiques particulières…, etc.
L’INSTABILITÉ GÉNÉTIQUE
Au fur et à mesure du développement de la maladie, les cellules tumorales acquièrent une instabilité génétique de plus en plus marquée, aboutissant à des mutations de plus en plus nombreuses.
La majorité des cancers chez l’homme se caractérisent par une instabilité chromosomique aussi appelée CIN (chromosomal instability).
La CIN est un phénomène dynamique se traduisant par le gain ou la perte de chromosomes entiers ainsi que par des remaniements structuraux des chromosomes. Ce processus contribue donc à l’aneuploïdie ( cellule qui ne possède pas le nombre normal de chromosomes) des cellules malignes et à la constitution d’une hétérogénéité intratumorale. De plus, la CIN est associée à un mauvais pronostic des tumeurs bronchiques, mammaires et colorectales.
ALTÉRATIONS GÉNÉTIQUES ACQUISES OU INNÉES ?
Les altérations héréditaires expliquent que certains rares types de cancers se transmettent dans certaines familles.
A l’opposé, les altérations acquises peuvent être le résultat d'une erreur dans la reproduction des cellules ou de l'exposition à des substances cancérogènes (substances chimiques cause du cancer) comme celles qui se trouvent dans la fumée de cigarette.
Les théories actuelles
À L'ÉCHELLE DE LA CELLULE
L’hypothèse d’une origine génétique à l’origine du processus de cancérisation
Elle a été évoquée pour la première fois par McCombs RS et McCombs RP dans leur publication " A Hypothesis on the Causation of Cancer " - Science New Series 1930;72(1869):423–4 .
Cette nouvelle théorie allait à l’encontre des hypothèses émises par les pathologistes allemands, au 19ème siècle, qui considéraient qu’un cancer émergeait à partir d’îlots de cellules embryonnaires demeurés dans les tissus.
Le Cancer Genome Project - CGP
Actuellement, le cancer est considéré comme une maladie des gènes, certainement à l’échelle somatique pour les cancers dits sporadiques mais beaucoup plus rarement à l'échelle germinale formes familiales ou héréditaires).
C'est ainsi que le Cancer Genome Project étudie de manière systématique les anomalies du génome de la cellule cancéreuse. Cette recherche a déjà permis d'identifier 400 gènes impliqués dans le développement de la maladie.
La modélisation
Elle est basée sur l'hypothèse de Knudson dites " two hits " développée pour le rétinoblastome. Elle a permis de modéliser la séquence des événements qui aboutit à la maladie.
Un premier événement aboutit à une mutation d'un gène.
- Cette première mutation peut être : germinale, dans les formes de cancers familiaux ou somatique , dans les formes sporadiques de la maladie
- Cette mutation conduit à l'hétérozygotie. A ce stade, un seul des deux chromosomes est le siège d'une mutation, d'où la formule CO.
Un second événement entraîne une mutation somatique et aboutit à la perte de l'hétérozygotie. Maintenant, les deux chromosomes présentent une mutation, d'où la formule CC. Cette seconde mutation permet aux cellules cancéreuses de se développer.
À L'ÉCHELLE MOLÉCULAIRE ...
On considère actuellement qu’un cancer est la résultante d'une ou plusieurs des anomalies suivantes :
- Une activation des oncogènes qui codent pour la production de protéines contrôlant la prolifération cellulaire, l’apoptose ou les deux,
- Une inhibition des gènes suppresseurs de tumeurs
- Une inhibition des gènes encodant des micro-ARN, impliqués dans la régulation de certains gènes.
Gènes & multiplication cellulaire
| Gènes | Fonctions |
|
Gènes promoteurs RET |
Prolifération (cycle), différenciation et apoptose |
| Gènes du maintien de l’intégrité du génome BRCA1, BRCA2, HMLH1, MHSH2, HMSH6 | Réparation de l'ADN |
Le rôle de l'horloge mitotique
La mitose est une période critique pour les cellules en raison du risque d'anomalies chromosomiques structurelles et numériques, anomalies appelées instabilité chromosomique. L’instabilité chromosomique est une caractéristique du cancer.
Durant la phase M, l'instabilité chromosomique est évitée grâce au point de contrôle de l'assemblage du fuseau, qui retarde la progression du cycle cellulaire jusqu'à ce que les chromosomes soient correctement attachés aux microtubules du fuseau, permettant une séparation correcte en cellules filles.
Récemment, un autre point de contrôle de la phase M a été décrit. Si une durée mitotique seuil est dépassée, la prolifération des cellules filles est arrêtée d'une manière qui implique le gène suppresseur de tumeur p53, l'inhibiteur du cycle cellulaire p21, la protéase spécifique de l'ubiquitine 28 (USP28) et la protéine de liaison p53 1 (53BP1). En cas de mitose prolongée, celle-ci induit l'assemblage d'un complexe USP28-53BP1-p53. Ce «chronomètre mitotique » intervient dans l'arrêt des cellules filles et peut prévenir le développement d’un clone de cellules cancéreuses.
Altérations des gènes dans les cancers
| Altérations | Mutations | Les délétions et insertions |
|---|---|---|
|
Au cours de la réplication (accidentelles ) |
Par substitution, c’est à dire remplacement d’un nucléotide par un autre |
1 ou 2 nucléotides, décalant le cadre de lecture (codons) |
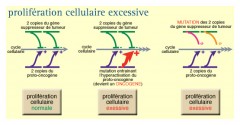
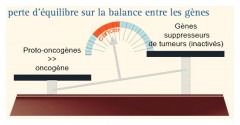
Les proto-oncogènes : stimulent la croissance tumorale
Les gènes suppresseurs de tumeurs : freinent la croissance
Les gènes régulant la mort cellulaire programmée : déclenchent l''apoptose
Les gènes de maintien de l'intégrité du génome : réparent les erreurs de l’ADN
Les oncogènes = accélérateurs de la division cellulaire...
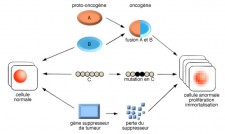
LES PROTO-ONCOGÈNES
Ils existent dans toute cellule animale des proto-oncogènes. On en dénombre 300 chez l'homme. Ce sont des gènes cellulaires normaux et indispensables à la prolifération physiologique cellulaire.
Les proto-oncogènes contrôlant les étapes de la croissance et de la différenciation cellulaires, lorsqu’ils sont activés, par une surexpression ou une mutation ponctuelle, ils contribuent, alors, à la transformation maligne de la cellule.
Tout proto-oncogène (c-onc), est susceptible de devenir, à la suite d’une modification qualitative ou quantitative, un gène transformant, c’est-à-dire un gène capable de conférer expérimentalement le phénotype cancéreux (transformation) à une cellule normale.
LES ONCOGÈNES
Ils proviennent de gènes cellulaires normaux : c'est une version mutée du proto-oncogène...
Le premier découvert fut le src (à prononcer sarc pour sarcome) par Ray Erickson en 1977. Depuis plus de 100 oncogènes ont été isolés. Ils codent alors pour une protéine stimulant à l’excès la division cellulaire.
L’atteinte d’une seule copie du gène (allèle)
Elle suffit pour activer l’oncogène : l'action des oncogènes est dite dominante.
Une mutation sur une seule copie du gène suffit, à elle seule, à déclencher une division cellulaire anormale et une prolifération excessive ou inappropriée.
Les protéines codées par ces gènes appartiennent, principalement, à différentes familles :
- Des facteurs de croissance cellulaire, FGF, PDGF, ...
- Des récepteurs trans-membranaire de facteurs de croissance, EGFR, IGFR, ...
- Des G-protéines ou protéines membranaires liant le GTP, comme le proto-oncogène de la famille du ras ..)
- Des protéines non récepteurs à propriété tyrosine kinase, comme l' abl )
- Des protéines à activité nucléaires, proto-oncogène erbA codant pour le récepteur aux hormones thyroïdiennes, les proto-oncogènes fos , jun et c-myc
- Des protéines impliquées dans l’apoptose, comme le bcl-2
Les protéines résultant de cette altération génétique (phénotype) stimulent normalement le déclenchement de la division cellulaire et prennent le nom d’oncoprotéines.
L'ACTIVATIONS DES ONCOGÈNES = ACCÉLÉRATION DE LA PROLIFÉRATION CELLULAIRE
La plupart des oncogènes correspondent à des gènes impliqués dans la régulation des processus de prolifération et de différenciation cellulaire. Ils peuvent être activés par :
- Intégration virale (virus)
- Mutation ponctuelle dans une séquence codante pour un proto-oncogène
- Délétion aboutissant à une perte de fonction ou une activation anormale (région régulatrice)
- Réarrangement structural : altérations chromosomiques (translocations, inversions…)
- Amplification génique : augmentation anormale du nombre de copies du gène dans la cellule,
- Dérégulation de l’expression, stabilisation d’un mRNA codant pour une oncoprotéine
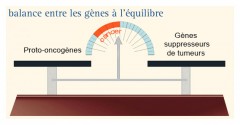
Les anti-oncogènes ou gènes suppresseurs de tumeurs = freins à la prolifération
UN FREIN À LA DIVISION DES CELLULES ...
Les 30 gènes suppresseurs de tumeurs connus...
Ils ont une fonction opposée à celle des oncogènes, jouant un rôle de frein sur la croissance et la prolifération cellulaire .
Expérimentalement, ils ont la capacité de bloquer la croissance cellulaire lorsqu’ils sont introduits par transfection dans les cellules tumorales. Cette propriété s’explique par la capacité de ces gènes à réguler négativement le cycle cellulaire, en agissant principalement en phase G1/S, et à induire l’apoptose ou mort cellulaire programmée.Ce sont des gènes intervenant dans le processus biologique normal d’une cellule.
Ces gènes ont une action dite récessive, c'est à dire que les deux copies du gène doivent être mutées pour qu'il n'y ait plus la fonction de frein à la division cellulaire.
| Gènes | Rôle | Conséquences pour la cellule |
|---|---|---|
| Oncogène |
L'accélérateur : nécessaire pour qu'une tumeur soit transformée |
Gain de fonctions |
| Suppresseur de tumeur |
Le frein : empêche la cellule de devenir cancéreuse, même en présence d'oncogènes |
Perte de fonction |
LES PROTÉINES ANTI-ONCOGÉNIQUES
La protéine oncogénique p105-Rb
Elle est codée par le gène suppresseur Rb ( Rb car dérivant d’un rétinoblastome ). Cette protéine appartient au système de contrôle de la prolifération cellulaire. Elle représente le point d'impact de l'activité de certains oncogènes.
La protéine codée par ces oncogènes agit par formation d'un complexe avec p105-Rb qui entraîne l'inactivation de l’oncogène.
La protéine p53
Le gène P53 , situé sur le chromosome 17, code pour une phosphoprotéine nucléaire de 393 acides aminés qui est encore appelé le gardien du génome. Elle protège la cellule des réarrangements génomiques ou de l'accumulation de mutations et supprime la transformation cellulaire due à l’activation d'oncogènes ou à la perte de la voie suppressive de tumeur.
Ce gène est le siège fréquent d’anomalies au cours des cancers. Si le génome, c'est-à-dire l'ADN, d’une cellule devient anormal à la suite d’une mutation, la protéine p53 agit comme un agent qui provoque soit l'arrêt de la division cellulaire soit l'apoptose qui est la mort cellulaire programmée ou suicide de la cellule. L'ensemble de ces phénomènes contribue à la stabilité de l'intégrité génétique.
Les cellules tumorales présentant une mutation du gène p53 ne sont plus capables d'assurer le maintien de l’intégrité génétique et la cellule ne reçoit donc plus de signal d'arrêt de division et d’apoptose. Elle ne peut donc plus être éliminée et peut continuer à proliférer. Son génome devient moins stable et il est alors susceptible d'accumuler des mutations permettant l'émergence de clones cellulaires de malignité accrue.
La théorie des "two hits" de Knudson ...
Ce sont les travaux d'Alfred Knudson, généticien américain, qui ont abouti à la théorie dite des " two hits " à partir du modèle du rétinoblastome (tumeur maligne rare de l’enfant affectant la rétine de l’œil).
Cette théorie montre que deux événements indépendants (hit) sont nécessaires pour inactiver le gène (altération du premier allèle du gène puis du second ultérieurement) et conduire à une transformation maligne. Par extension, on considère maintenant comme gène suppresseur de tumeur, tout gène dont la perte de fonction contribue à l’oncogenèse.
On connaît une vingtaine de gènes suppresseurs de tumeurs. Les plus connus sont les gènes P53, PTEN, Rb et ATM.
| Proto-oncogène | Anti-oncogène (gène suppresseur de tumeur) |
|---|---|
|
Une seule mutation nécessaire pour activer leur action (oncogène ⇒ mutation activatrice Activation transduction signal Stimulation de la prolifération cellulaire |
Deux mutations nécessaires pour inactiver leur action Gate keepers : aux points de contrôle cycle cellulaire Care takers : sur les gènes de réparation des anomalies de l’ADN |
Schématiquement, la théorie dite des "two hits"
Cellule Normale (allèles 1 et 2 normaux)
Première mutation
⇓
Cellule Mutée (allèle 1 normal et allèle 2 muté)
Seconde mutation (second hit)
Somatique (mutation)
⇓
Cellule Cancéreuse (allèle 1 et allèle 2 mutés)
LES PROTÉINES ONCOGÉNIQUES (ONCO-PROTÉINES)
LES ONCOPROTÉINES
Elles sont transcrites à partir des gènes mutés impliquées dans des fonctions cellulaires primordiales. Le dérèglement de ces fonctions cellulaires essentielles entraîne la prolifération tumorale.
Elles interviennent dans la série d’événements qui vont de la transmission de signaux extracellulaires par l'intermédiaire de récepteurs de surface de la cellule à la commande directe sur le noyau de la mise en route des signaux commandant la division cellulaire. Celles impliquées dans la transduction des signaux de prolifération…
LES DIFFÉRENTES FAMILLES
Les facteurs de croissance
Les principaux facteurs de croissance cellulaire sont :
- Le facteur plaquettaire de croissance (PDGF)
- Le facteur de croissance des fibroblastes (FGF)
- Le facteur épidermique de croissance (EGF)
Par exemple, la protéine codée par l'oncogène sis , est un analogue anormal du PDGF ( Platelet Derived Growth Factor ). Cette protéine mutée ne peut agir que si la cellule possède à sa surface un récepteur auquel elle peut se lier. Si le récepteur est présent, les cellules peuvent alors se multiplier et proliférer.
Les récepteurs des facteurs de croissance
Un récepteur peut être comparé à un trou de serrure. La protéine spécifique du récepteur, le ligand, peut être comparée à la clé de la serrure. S’il s’agit de la bonne clé, le récepteur transférera l’information aux circuits de transduction à l'intérieur de la cellule qui à son tour synthétisera des protéines spécifiques.
Les récepteurs à la surface d’une cellule sont des protéines. Ces protéines peuvent muter et se comporter anormalement. Par exemple, la protéine codée par l'oncogène erb B , est un analogue muté du récepteur cellulaire du facteur de croissance épidermique EGFR ( Epidermal Growth Factor Receptor ).
La stimulation de ce récepteur entraîne la transmission d'un signal qui permet de stimuler la division cellulaire par l'intermédiaire de l’activation d’une enzyme, la tyrosine kinase. Une des explications avancée serait que la protéine oncogénique posséderait la même capacité fonctionnelle mais serait insensible aux systèmes de régulation, ce qui aurait pour effet le détournement des processus de division cellulaire au profit de la prolifération tumorale.
D’autres récepteurs peuvent, aussi, être en cause comme, par exemple le récepteur Erb-B2, impliqué dans certains cancers du sein ou le récepteur Kit.
Une oncoprotéine simulant une activité enzymatique normale….
La transmission des informations reçues par une cellule fait appel à des processus complexes impliquant des protéines spécifiques : les enzymes. Parmi ces enzymes, les protéines kinases membranaires sont très importantes pour la transmission des informations vers le noyau de la cellule. Par exemple les protéines kinases membranaires, codées par le gène src du RSV exercent un rôle régulateur important dans le fonctionnement de nombreuses protéines cellulaires, comme les protéines du squelette cellulaire ou les protéines impliquées dans l’inflammation.
Une oncoprotéine stimulant l’activité du noyau de la cellule….
Les protéines oncogéniques dites transformantes sont codées par les gènes c-myc . Elles sont présentes dans le noyau. Elles agissent vraisemblablement en stimulant la division cellulaire en agissant au début du cycle cellulaire.
Les autres oncoprotéines appartiennent aux classes suivantes :
Elles peuvent appartenir aux classes suivantes
- Les protéines contrôlant le cycle cellulaire : les cyclines, comme la cycline D1, les kinases cycline-dépendantes, Cdk4, les phosphatases, comme la Cdc25.
- Les protéines régulant négativement l’apoptose : les protéines de la famille Bcl2 : Bcl2, Bcl-X1, la survivine, les protéines permettant l’immortalisation des cellules, comme la télomérase.
- Les protéines impliquées dans la dissémination des cellules et les métastases : les métalloprotéinases et les protéines assurant l’adhésion cellulaire
- Les protéines stimulant l’angiogenèse, comme les facteurs de croissance angiogènique VEGF
Toutes ces protéines sont des cibles potentielles pour les biothérapies du cancer, les biochimiothérapies.
EN PRATIQUE...
La production d'une protéine anormale
C’est la conséquence d’une mutation portant sur les séquences codantes du gène, c’est-à-dire sur les parties permettant la construction d’une protéine. Cette mutation entraîne, alors, la transcription d'une protéine anormale dite oncogénique. Cette protéine ressemble à la protéine normalement codée par le gène correspondant mais possède des propriétés anormales.
Elle peut être mise en évidence par le dosage dans le sang de la protéine qui est alors ce que l'on appelle un marqueur tumoral .
L'augmentation de la production d'une protéine normale
Elle est observée lorsque la mutation touche les séquences régulatrices ou non-codantes du gène, c’est-à-dire celles qui n’induisent pas la synthèse d’une protéine. Cette modification quantitative entraîne la production en quantité anormale d'une protéine normale.
Mise à jour
29 mars 2024

