Les inhibiteurs de points de contrôle
LES INHIBITEURS DES POINTS DE CONTRÔLE IMMUNITAIRES (ICP)
DES ANTICORPS MONOCLONAUX
Une cible privilégiée : les tumeurs présentant de multiples mutations...
Ce sont des médicaments qui reconnaissent spécifiquement certaines types de cellules tumorales.
Les tumeurs avec des mutations multiples génèrent des néo-antigènes qui favorisent le recrutement intratumoral de lymphocytes T CD8+ et la réponse clinique à ce type de médicaments, comme cela est observé dans les tumeurs déficientes dans le système du mismatch-repair (MMR).
De ce fait, les tumeurs qui présentent un grand nombre de mutations sont particulièrement immunogènes, comme le mélanome, certains cancers du poumon ou de la vessie, par exemple. Elles seront une cible privilégiée pour ce type de traitement.
Leur structure
Les anticorps monoclonaux humanisés ou humains ont une structure d'immunoglobuline (anticorps) sont de type IgG4 ou IgG1, selon le type de médicament.
Leur mode d'action
Ils ciblent une protéine précise exprimée sur la membrane des cellules tumorales. Ils bloquent l’interaction entre la cellule tumorale et la cellule immunitaire effectrice (cellule dendritique ou lymphocyte) à l’origine de la réponse immunitaire antitumorale spécifique.
Ces médicaments ont pour objectif principal de lever l’inhibition de la réponse immune cytotoxique spécifique qui peut être induite par les cellules tumorales et contribuer, ainsi, à leur destruction..
COMMENT "ÇA MARCHE" ?
L’administration d’anticorps monoclonaux dirigés contre des molécules de co-stimulation inhibitrices ou leurs ligands permet de rétablir les capacités fonctionnelles des lymphocytes T "épuisés" et non fonctionnels. Ce rétablissement se traduit par une amélioration très importante de la maladie sur une proportion de patients (20 à 30 %), souffrant de mélanomes avancés, de certains cancers du poumon, de cancers du rein, de cancers colorectaux et de cancers des voies urinaires (urothéliaux).
Les inhibiteurs de CTLA-4
LES ANTI-CTLA-4
Le mécanisme d'action repose sur le blocage de la protéine CTLA-4 (Cytotoxic T-Lymphocyte Antigen 4), exprimée à la surface des lymphocytes et dont le rôle physiologique est de limiter l’activation du système immunitaire en bloquant l'interaction avec le récepteur B7 présent à la surface de la cellule présentatrice d’antigène (APC).
En bloquant l’attachement du CTLA-4 au récepteur B7, cette stratégie thérapeutique permet de maintenir l'action antitumorale des cellules T et ainsi, en retour, à celles ci de s'attaquer aux cellules tumorales.
Le médicament
C'est un anticorps monoclonal humanisé de type IgG1. Utilisé seul ou en association avec la chimiothérapie, c'est la première chimiothérapie capable d'augmenter la survie dans les formes évoluées de mélanome.
L'essai princeps publié dans le New England Journal of Medicine , a enrôlé 676 patients répartis en trois groupes de traitement : le premier n'a reçu que l'ipilimumab, le deuxième a reçu la molécule en combinaison avec un vaccin, appelé gp100 augmentant la réponse immunitaire mais sans activité antitumorale, le troisième n'a reçu que le vaccin. Le critère principal de jugement était la survie globale.
Pour le premier groupe, la médiane fut de 10,1 mois, pour le second de 10 mois et, pour le troisième, de 6,4 mois. De plus, 23,5% des patients du premier groupe étaient encore vivants après 24 mois de traitement.
Un deuxième essai, en traitement de première ligne, en association avec la dacarbazine portant sur 502 malades, a, lui aussi, montré une augmentation significative de la survie.
Les indications homologuées
- Traitement du mélanome avancé (non résécable ou métastatique) en monothérapie dans le mélanome avancé (non résécable ou métastatique) (à partir de la 2ème ligne sans mutation BRAF, à partir de la 3ème ligne si mutation BRAF) ou en association au nivolumab dans le mélanome avancé (non résécable ou métastatique) (en 1re ligne sans mutation BRAF et sans métastase cérébrale active)
- Traitement du cancer du rein à cellules rénales en association au nivolumab, en 1re ligne, dans le CCR avancé de pronostic intermédiaire/défavorable;
Le traitement d’induction se fait à la dose de 3 mg/kg en perfusion intraveineuse à l'hôpital, sur une période de 90 minutes, toutes les 3 semaines pour un total de 4 doses.
Les effets indésirables
La toxicité de l'ipilimumab n'est pas négligeable et les effets secondaires peuvent être sévères, de longue durée mais la plupart sont réversibles. Les principales cibles de la toxicité induite sont la peau, le tube digestif, le foie et l’axe hypothalamo-hypophysaire.
Manifestations cutanées
Elles sont fréquentes, mais de grade modéré et ne mettent le plus souvent pas en jeu le pronostic vital, ni même la poursuite du traitement.
Colites inflammatoires
Elles se manifestent par des diarrhées et des douleurs abdominales. Ces manifestations sont observées chez 25 à 50 % des patients traités par 10 mg/kg d’ipilimumab. Chez 5 à 20 % d’entre eux, la diarrhée peut être de grade 3 à 4. Des complications graves, à type de perforations coliques, ont été observées dans moins de 1 % des cas.
Hépatites d’allure auto-immune
Elles ont été observées chez 3 % à 9 % des patients.
Des hypophysites
Elles ont été rapportées chez 1 à 8 % des patients. Le traitement repose sur la substitution hormonale qui peut parfois être prolongée voire définitive car cette atteinte, à l’inverse des colites et des hépatites, semble pouvoir persister.
D'autres toxicités
Des pancréatites ont été rapportées dans 1 % à 3 % des cas avec des élévations des enzymes amylase et lipase.
Des atteintes oculaires, à type d’uvéite ou d’épisclérite, sont été rapportées chez moins de 2 % des patients et elles régressent en général sous traitement symptomatique.
Des neuropathies sensitives ou motrices, elles ont été rapportées dans 1 % des cas.
Manifestations auto-immunes et prédiction de la réponse clinique
Il semble exister une corrélation entre les réponses cliniques et les manifestations d’auto-immunité
C'est le second médicament de cette classe thérapeutique. Il est homologué Il est indiqué en association avec le durvalumab en traitement de première ligne :
- Du carcinome hépatocellulaire avancé ou non résécable. La posologie est de 300 mg en une seule dose administrée en association avec 1 500 mg de durvalumab au jour 1 du cycle 1, suivi du durvalumab en monothérapie toutes les 4 semaines.
- Du cancer bronchique non à petites cellules métastatique en l’absence de mutation activatrice de l’EGFR ou de l’ALK, en association au cisplatine La posologie est de 75 mg en association avec 1 500 mg de durvalumab et une chimiothérapie à base de platine toutes les 3 semaines (21 jours) pendant 4 cycles (12 semaines). Après la chimiothérapie à base de platine : 1 500 mg de durvalumab toutes les 4 semaines. Une cinquième dose de 75 mg doit être administrée à la semaine 16 en même temps que la dose 6 de durvalumab
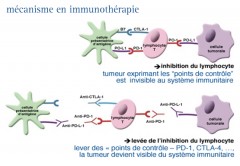
L'inhibition du PD1 ou de son ligand PDL-1
LE RECEPTEUR PD-1 & SON LIGAND PDL-1
La molécule de costimulation PD-1 (Programmed cell Death-1) est exprimée à la surface des lymphocytes T. Son ligand, le PDL-1, est pour sa part exprimé par les cellules tumorales.
Il existe, également, une autre protéine, PD-2, avec un autre ligand, PDL-2.
La liaison de PD-L1 avec PD-1 entraîne l’inactivation des lymphocytes T…
On observe une diminution de la réponse T antitumorale dans les tissus périphériques, comme par exemple, au sein des métastases.
Il se crée alors une sorte de bouclier, “rendant invisible” la cellule cancéreuse au système immunitaire du patient. En outre, cette liaison provoque l’épuisement T ‟T cell exhaustion”.
QUAND IL Y A BLOCAGE....
Ces traitements n’induisent pas une réponse immunitaire antitumorale mais amplifie une réponse lymphocytaire T préexistante pour laquelle les lymphocytes T CD8+ jouent un rôle dominant.
Lorsque cette liaison est bloquée, le système immunitaire est alors capable de reconnaître et de réagir contre les cellules cancéreuses.
De plus, les médicaments ciblant le PD-1 et son ligand PDL-1 agissent, non seulement sur les lymphocytes T mais aussi sur les lymphocytes B et les cellules "tueuses", NK.
LES ANTI-PD-1
Le nivolumab est un anticorps monoclonal humain de type IgG4 anti-PD-1, qui prévient la transformation du lymphocyte T effecteur en lymphocyte T cytotoxique.
Ce médicament induit des taux de réponse jusque-là inégalés chez les patients atteints de mélanome métastatique. Ces taux sont supérieurs de 5 à 10 % à ceux observés avec les autres immunothérapies utilisées dans le mélanome métastatique. Les taux de survie globale observés sont de 44 % à 2 ans et de 40 % à 3 ans.
Les indications homologuées (France)
- Mélanome
- En monothérapie ou en association à l’ipilimumab dans le mélanome avancé (non résécable ou métastatique) en 1re ligne sans mutation BRAF et sans métastase cérébrale active)
- En monothérapie en adjuvant dans le mélanome avec atteinte des ganglions lymphatiques ou métastatique, après résection complète
- Avec une autorisation temporaire d’utilisation (ATU) pour l'indication mélanome en première ligne.
- Cancer bronchique non à petites cellules (CBNPC)
- En monothérapie dans le CBNPC localement avancé ou métastatique, après chimiothérapie antérieure
- Carcinome à cellules rénales (CCR)
- En monothérapie dans le CCR avancé après un traitement antérieur
- En association à l’ipilimumab, en 1re ligne, dans le CCR avancé de pronostic intermédiaire/défavorable
- Lymphome de Hodgkin classique
- En monothérapie en cas de rechute ou réfractaire après une greffe de cellules souches autologue (GCSA) et un traitement par brentuximab vedotin
- Cancer épidermoïde de la tête et du cou :
- En monothérapie, en rechute ou métastatique, en progression pendant ou après une chimiothérapie à base de sels de platine
- Carcinome urothélial (vessie)
- En monothérapie dans le carcinome urothélial localement avancé non résécable ou métastatique après échec d’une chimiothérapie à base de sels de platine
- En monothérapie dans le carcinome urothélial localement avancé non résécable ou métastatique après échec d’une chimiothérapie à base de sels de platine
La dose recommandée est de 3 mg/kg délivrée en perfusion intraveineuse à l'hôpital, toutes les 2 semaines en monothérapie .
Les effets secondaires les plus fréquents sont une lymphopénie, la fatigue, et un taux de lipase augmenté.
Les effets secondaires sévères sont de la diarrhée, des problèmes endocriniens, des pneumopathies et des hépatites.
Les indications homologuées (France)
- Mélanome
- En monothérapie dans le mélanome avancé (non résécable ou métastatique)
- En monothérapie en adjuvant dans le mélanome de stade III avec atteinte ganglionnaire, ayant eu une résection complète (O)
- Cancer bronchique non à petites cellules (CBNPC)
- En monothérapie en 1re ligne des formes métastatiques, PD-L1 avec un score de proportion tumorale (TPS) ≥ 50 %, sans mutation d’EGFR ou d’ALK
- En association à le pémétrexed et sel de platine, en 1ère ligne du CBNPC métastatique non épidermoïde, sans mutation d’EGFR ou d’ALK
- En association au carboplatine et au paclitaxel ou au nab-paclitaxel, en 1ère ligne pour les formes métastatiques et de type épidermoïde
- En monothérapie dans les formes localement avancées ou métastatiques, PD-L1 avec TPS ≥ 1 %, après au moins un traitement systémique antérieur
- Lymphome de Hodgkin classique (LHc) en monothérapie dans les forme en rechute ou réfractaires après échec d’une greffe de cellules souches (GCS) autologue et d’un traitement par brentuximab vedotin (BV), ou inéligibles à une greffe et après échec de ce dernier traitement
- Cancer de la vessie et des voies excrétrices du rein en monothérapie
- Dans les formes localement avancées ou métastatiques après chimiothérapie à base de sels de platine
- Dans les carcinomes avancés ou métastatiques inéligibles à une chimiothérapie par cisplatine, PD-L1 avec score positif combiné (CPS) ≥ 10
- Carcinome épidermoïde de la tête et du cou (CETEC)
- En monothérapie ou en association à une chimiothérapie à base de sels de platine et de 5-fluorouracile (5-FU) en 1re ligne du CETEC métastatique ou récidivant non résécable, PD-L1 avec CPS ≥ 1
- En monothérapie dans le CETEC récidivant ou métastatique, PD-L1 avec TPS ≥ 50 % et en progression pendant ou après une chimiothérapie à base de sels de platine)
- Cancer du rein en association à l’axitinib, en 1ère ligne
- Cancer du sein triple négatif en association à la chimiothérapie pour le traitement adjuvant et néoadjuvant des cancers localement avancés à haut risque.
- Des tumeur solides présentant une instabilité microsatellitaire (prouvée par un test biologique démontrant un défaut de mésappariement de l’ADN -dMMR) comme certains cancers colorectaux. (indication agnostique basée sur un test biologique)
Le médicament est administré en perfusion intraveineuse pendant 30 minutes toutes les 3 semaines. La dose recommandée est de 200 mg dans le cancer du poumon qui n’a pas été précédemment traité par chimiothérapie, la maladie de Hodgkin, le carcinome urothélial (cancer de la vessie) et de 2 mg/kg dans les cancers du poumon déjà traités par chimiothérapie ou dans le mélanome. Les patients doivent être traités jusqu’à progression de la maladie ou toxicité inacceptable.
Les effets indésirables, le plus souvent rencontrés sont de la fatigue, un prurit, des rash cutanés, de la diarrhée, des douleurs articulaires (arthralgie), des nausées et des problèmes d'origine immunologique.
C'est un autre anticorps monoclonal ciblant le checkpoint PD1.
Il est homologué pour le traitement de certains cancers réfractaires de l'endomètre mismatch repair deficient (dMMR).
C'est un inhibiteur du point de contrôle PD1. Il est indiqué en monothérapie pour le traitement
- Des cancers de la peau
- Epidermoïdes cutanés métastatiques ou localement avancés (CECm ou CECla) qui ne sont pas candidats à une chirurgie curative ni à une radiothérapie curative.
- Basocellulaires localement avancés ou métastatiques (CBCla ou CBCm) ayant progressé ou présentant une intolérance à l'Odomzo™ (sonidegib), un inhibiteur de la voie Hedgehog (IHH).
- Des cancers bronchopulmonaires non à petites cellules en monothérapie en traitement de première ligne exprimant PD-L1 (dans ≥ 50 % des cellules tumorales) sans altérations du gène EGFR, ALK ou ROS1, localement avancés et qui ne sont pas candidats à une radiochimiothérapie, ou métastatiques
La dose recommandée est de 350 mg administrée toutes les 3 semaines par perfusion intraveineuse de 30 minutes. Le traitement est poursuivi jusqu’à progression de la maladie ou une toxicité inacceptable.,
LES ANTI-PDL-1
C'est un anticorps monoclonal bloquant le ligand PDL-1. Les indications homologuées sont :
- Carcinome urothélial
- En monothérapie dans les formes localement avancées ou métastatiques après chimiothérapie à base de sels de platine
- En monothérapie dans les formes localement avancées ou métastatiques inéligiblse au cisplatine et PD-L1 > 5 %
- CBNPC
- En association avec le bévacizumab, paclitaxel et carboplatine, en 1re ligne des CBNPC non épidermoïdes, et après thérapie ciblée en cas d’altération d’EGFR ou ALK
- En monothérapie dans le CBNPC localement avancé ou métastatique après chimiothérapie, et après thérapie ciblée en cas d’altération d’EGFR ou ALK
- En traitement adjuvant sous certaines conditions
C'est un anticorps monoclonal bloquant le ligand PDL-1. Il est homologué pour le traitement :
- En monothérapie du cancer du poumon localement avancé, non opérable, PD-L1 ≥ 1 % et en maintenance après chimioradiothérapie à base de platine.
- En monothérapie pour le traitement des cancers du poumons non à petites cellules localement avancé, non opérable, PD-L1 ≥ 1 % et en maintenance après chimioradiothérapie à base de platine
- Des cancers de la vessie évolués
C'est aussi un anticorps monoclonal bloquant le ligand PDL-1... Comme les autres médicaments de cette classe d'immunothérapie, il se lie au ligand PD-L1 et bloque l'interaction entre le ligand et son récepteur, PD-1 (protéine de mort programmée 1) et B7.1. Cela conduit à la suppression des effets inhibiteurs du PD-L1 sur les lymphocytes T CD8+ cytotoxiques, rétablissant ainsi les réponses antitumorales des lymphocytes T. L'avelumab induirait également une lyse (destruction) directe des cellules tumorales par les cellules "tueuses" dites Natural Killer (NK) par un mécanisme faisant intervenir la cytotoxicité à médiation cellulaire dépendante des anticorps (ADCC).
Il est homologué en monothérapie dans le carcinome à cellules de Merkel métastatique et prétraité et en association avec axitinib, en 1ère ligne du cancer du rein à un stade avancé
Il est en développement dans le cancer du poumon et le cancer du sein "triple négatifs".
La dose recommandée est de 10 mg/kg à administrer par voie intraveineuse pendant 60 minutes toutes les 2 semaines.
Les effets indésirables les plus fréquents sont de la : fatigue, des nausées, des diarrhées, une diminution de l'appétit, une constipation, des réactions liées à la perfusion, une perte de poids et des vomissements (16,2 %)
AUTRES MOLÉCULES
Des nombreux médicaments ayant cette cible sont en développement comme, par exemple, le tislélizumab (Phase-III contre le docétaxel), dans le traitement du cancer du poumon, le pidilizumab pour le traitement des lymphomes à grandes cellules et le mélanome métastatique.
Une utilisation de plus en plus large....
Le nombre de patients traités par inhibiteurs de points de contrôle est passé de 36 315 en 2019 à 51 684 en 2020 soit une augmentation de 42 %...
La recherche de marqueurs prédictifs de l'efficacité...
UNE EFFICACITÉ SPECTACULAIRE MAIS DANS SEULEMENT 30 % DES CAS...
Les différentes immunothérapies proposées dans le traitement des cancers du poumon ne sont efficaces ou très efficaces que dans environ 30 % des cas.
On sait que l'immunothérapie à d'autant plus de chances d'être efficace que la tumeur présente de nombreuses mutations. La présence de ces mutations ferait que ces cellules seraient plus visibles au système immunitaire réactivé.
C'est dans ce contexte que les chercheurs ont recherché des marqueurs qui pourraient permettre de prédire l’efficacité des traitements.
LA CHARGE MUTATIONNELLE (CM)
La charge mutationnelle est un ratio entre le nombre de gène tumoraux altérés par rapport au nombre total de gènes étudiés. Des études récentes (POPLAR et OAK) ont montré que ce ratio serait le biomarqueur permettant d'améliorer la prédiction de l’efficacité de l’immunothérapie.
DEMAIN...
La recherche actuelle travaille à l’élaboration de biomarqueurs qui distingueraient les tumeurs inflammatoires dites « chaudes » (riches en TILs), susceptibles de répondre aux inhibiteurs des « checkpoints », des tumeurs dites « froides », non susceptibles de répondre, et cherche à développer des moyens de rendre « chaudes » les tumeurs « froides », grâce à des traitements conventionnels comme la radiothérapie et/ou des molécules innovantes.
Des pistes pour identifier les malades répondeurs...
LES BONS RÉPONDEURS
Les études ont permis d'identifier certains facteurs chez les patients répondeurs à ces thérapeutiques :
- La présences de nombreux néo-épitopes* spécifiques des cellules tumorales qui sont à l'origine d'une immunogénicité tumorale liée au fort taux de mutations et autres altérations génétiques, comme dans le cas des mélanomes
- Une infiltration en lymphocytes T CD8+ cytotoxiques (de phénotype résident mémoire)
- Une expression de PDL-1 (et/ou de PDL2) dans l’environnement de la tumeur, stimulant l'activité des médicaments
- Une signature transcriptomique** de lymphocytes T activés (IFNγ, gènes de cytotoxicité) accentuant la réponse
LES NON-RÉPONDEURS
Les tumeurs qui ne répondent pas au traitement présentent des déficiences dans certains de ces marqueurs liés soit à des altérations directes des voies de présentation des antigènes ou des réponses aux interférons***, soit à l’activation de certaines voies d’oncogenèse qui semblent s’opposer à l’infiltration ou à l’activation des lymphocytes T ou d’autres cellules immunes. Les éléments connus impliqués dans les mécanismes de réponse et de résistance sont :
- L’infiltration en cellules myéloïdes et/ou macrophages
- L’expression d’autres ligands/récepteurs ou enzymes inhibiteurs des points de contrôle (TIM3, LAG-3, TIGIT, VISTA, CD39/CD73, IDO)
- La production de ligand du récepteur PD1 différents
- Le microbiote commensal et l’impact des antibiotiques
* Néo-épitopes peptides liés au complexe majeur d'histocompatibilité
** Transcriptomique est l'étude de l'ensemble des ARN messagers produits lors du processus de transcription d'un génome
*** Interférons sont des protéines produites suite à une infection virale. En se fixant sur leurs cellules cibles, ces cytokines déclenchent chez celles-ci diverses réactions permettant la mise en place d'un état de résistance aux virus.
Un profile de tolérance spécifique...
Globalement, l'immunothérapie est mieux tolérée que la chimiothérapie.
Le taux d'événements indésirables graves (grades 3 et 4) est plus faible avec l'immunothérapie (10 % contre 54 %) et, surtout, on observe moins d’arrêts de traitements en raison d'événements indésirables (5 % contre 15 %). Néanmoins, les effets indésirables sont différents. De plus, les effets indésirables de l'immunothérapie sont plus imprévisibles et peuvent survenir à tout moment pendant le traitement, et parfois même après, et qu'ils sont réversibles par un traitement par corticostéroïdes.
L'immunotoxicité diffère selon la classe d'inhibiteurs de points de contrôle immunitaires.
Les événements d'ordre immunitaire sont plus fréquents avec les inhibiteurs de CTLA-4 qu'avec les inhibiteurs de-1 et de-L. Des réactions cutanées peuvent survenir avec les inhibiteurs de CTLA-4, mais les effets indésirables gastro-intestinaux de grade 3 à 5, sont parfois marqués.
Le profil d'immunotoxicité est très différent avec les agents anti-PD1, pneumonie, thyroïdite et les arthralgies sont les plus fréquents, tandis que les événements indésirables liés au système immunitaire sont moins fréquents avec les agents antiPDL1
L'immunotoxicité associée à l'immunothérapie varie également selon le type de tumeur traitée. Les patients traités pour un mélanome ont des taux plus élevés de vitiligo (environ 10 %), tandis que les patients atteints d'un cancer du poumon non à petites cellules (CPNPC) et ceux atteints d'un carcinome rénal sont plus susceptibles de présenter une infection pulmonaire, et ceux traités pour un carcinome thymique peuvent avoir une myocardite.
Les manifestions indésirables (immune-related adverse events (IRAEs)
LES FAITS
Selon les molécules et les protocoles utilisés, de 30 à 90 % des patients traités peuvent présenter des effets indésirables de nature immunologique (IRAE). Les mécanismes physiopathologiques sont encore mal connus. Ces manifestations sont parfois difficiles à reconnaître, car variables dans leur présentation, et variables selon leur localisation, chronologie, sévérité. De plus, au début, la symptomatologie peut être "fruste". Ces complications peuvent amener à arrêter le traitement.
La présence d’une maladie auto-immune ou inflammatoire préexistante est le principal facteur de risque clinique associé.
L’utilisation concomitante d’un anti-CTLA-4 et d’un anti-PD-1 favorise les manifestations immunitaires et les biomarqueurs prédictifs de la toxicité ne sont pas utilisable en pratique courante.
LES PROBLEMES RENCONTRÈS
Les principales toxicités immunologiques sont d’ordre dermatologique, digestif, hépatique, endocrinien, rhumatologique, pulmonaire, rénal, neurologique, cardiaque, hématologique et oculaire.
Ces médicaments présentent également un risque spécifique chez les sujets ayant des antécédents de maladie auto-immune ou une pathologie du thymus car, l’utilisation de ces molécules peut réactiver la maladie sous-jacente, l’accentuer, et accentuer leur toxicité immunologique. Néanmoins, le côté plus positif est que la présence d’une maladie auto-immune préexistante ne semble pas impacter l'efficacité du traitement.
GLOBALEMENT
Les principales toxicités des deux classes de médicaments sont assez similaires, néanmoins, les anti-PD1/anti-PD-L1 seraient mieux tolérés. Les mécanismes supposés comme étant impliqués dans la survenue des IRAEs (Immune-Related Adverse Events) sont :
- Une activité accrue de l’activité "T "cytotoxique contre des antigènes présent à la fois à la surface des cellules tumorales et du tissu sain responsable de l'atteinte cardiaque (myocardite), ou du vitiligo*.
- L’augmentation du taux d’anticorps préexistants (atteinte thyroïdienne) ou des cytokines pro-inflammatoires (atteinte digestive)
- Une inflammation induite par une activation excessive du complément secondaire à la liaison entre l'inhibiteur du checkpoint et checkpoint immunitaire exprimé par le tissu sain (liaison anti-CTLA-4/CTLA-4 dans l’atteinte hypophysaire).
LES EFFETS INDÉSIRABLES D'ORIGINE IMMUNOLOGIQUE
Du fait de leur mode d'action, ces médicaments sont associés le plus souvent à des effets indésirables d’origine immunologique potentiellement graves et parfois imprévisibles. Ils peuvent survenir dès l’instauration de l’immunothérapie et jusqu’à plusieurs mois après la fin du traitement. Leur gestion implique, souvent, la mise en œuvre, paradoxale, d'un traitement immunosuppresseur.
L’activation immunitaire associée à ces traitements entraîne une perte de tolérance immunitaire qui ne se limite pas à la tumeur, avec l’apparition de manifestations inflammatoires, pouvant toucher tous les organes.
Les effets secondaires en relation avec l'activation des lymphocytes T.
On target & Off target !
Lorsque la réponse cellulaire (lymphocyte T) est dirigée vers les antigènes tumoraux, on parle alors d'effets secondaires "on target" affectant la tumeur (effet recherché) mais, aussi parfois, les tissus sains "off target" (effet indésirable).
Néanmoins, peut émerger une réaction contre des antigènes non tumoraux "off target" pouvant aboutir à l'émergence d'auto-anticorps (anticorps dirigés contre ses propres cellules) et la libération d'auto-antigènes.
La libération de cytokines (interféronγ ou interleukine 17 -IL17)
Ces effets sont variables et sont prévenus par des prémédications spécifiques. Ils sont potentiellement graves et parfois imprévisibles. Ils peuvent survenir dès l’instauration de l’immunothérapie et jusqu'à plusieurs mois après la fin du traitement. La gestion de ces effets secondaires repose souvent sur la prescription d’un traitement immunosuppresseur.
Les autres effets secondaires
LEUR NATURE
Les effets secondaires les plus souvent rencontrés avec cette classe de médicaments sont :
- Les manifestations dermatologiques (rash, prurit, vitiligo)
- Les problèmes endocriniens (thyroïdite, plus rarement hypophysite)
- Les troubles digestifs (colite), hépatiques (hépatite)
- Les toxicités pulmonaires (pneumopathie)
- Les effets indésirables rhumatologiques (arthrite, pseudo-polyarthrite, syndrome sec, plus rarement myosite)
Des effets indésirables plus rares rapportés :
- Neurologiques (encéphalite, méningite, neuropathie)
- Rénaux (néphrite tubulo-interstitielle)
- Cardiologiques (myocardite)
- Ophtalmologiques (uvéite)
- Hématologiques (cytopénies auto-immunes)
- Systémiques (vascularite, connectivite)
Ils peuvent survenir à tout moment au cours du traitement, quelques jours seulement après la première perfusion, ou parfois une année après la fin du traitement.
Les symptômes cutanés (rougeurs et démangeaisons par exemple) sont les effets secondaires les plus fréquents liés aux anti-CTLA-4 et aux anti-PD-1/PD-L1,
Les symptômes gastro-intestinaux, notamment la diarrhée, apparaissent plus fréquemment avec les anti-CTLA-4.
Les symptômes pulmonaires et les troubles de la thyroïde apparaissent plus fréquemment avec les anti-PD-1/PD-L1.
LEUR PRISE EN CHARGE
Un effet indésirable de ce type de grade 1 ne nécessite qu'une simple surveillance avec, si nécessaire, un traitement symptomatique. À partir d’un grade 2, une corticothérapie pourra être proposée, avec de fortes doses.
Pour les grades 3 et 4 un arrêt (temporaire ou définitif) du traitement s'impose souvent.
INFLUENCE DE LA FLORE INTESTINALE (MICROBIOTE)
Dans des travaux récents, une analyse du microbiote intestinal de patients a révélé que la présence de la bactérie Akkermansia muciniphila était associée à une meilleure réponse thérapeutique à une immunothérapie par anti-PD1.
Une supplémentation orale avec Akkermansia muciniphila après transplantation de microbiotes fécaux avec des fèces de patients non répondeurs, a restauré l’efficacité du blocage de PD1.
* Vitiligo = maladie de la peau qui se caractérise par des taches blanches (dépigmentation) qui apparaissent et s'étendent sur n'importe quelle partie de la peau. Ce défaut pigmentaire atteint surtout le visage, les extrémités, les articulations et les zones de frictions.
Bilan endocrinien nécessaire
- Glycémie à jeun (pour les anti-PD1/PD-L1)
- Natrémie
- Hormones thyroïdiennes : TSH, T4
- Cortisol à 8 heures (en absence de prise de corticoïdes)
- LH, FSH, testostérone chez l’homme ; LH, FSH estradiol chez la femme avec des cycles irréguliers ; FSH chez la femme ménopausée
Les inhibiteurs de check-point immunologique (ICP) homologués.
|
Cible |
Médicament |
Indications homologuées |
|---|---|---|
|
CTLA4 |
Ipilimumab (Yervoy™) |
Mélanome cutané avancé |
|
PD1 |
Nivolumab (Opdivo™) |
Mélanome cutané avancé |
|
Pembrolizumab (Keytruda™) |
Mélanome |
|
|
Cemiplimab (Liptayo™) |
Cancers épidermoïdes de la peau |
|
|
Dostarlimab (Jemperli™) |
Cancer de l'endomètre en rechute dMMR |
|
|
PD-L1 |
Atezolizumab (Tecentriq™) |
Vessie |
|
Durvalumab (Imfinzi™) |
Poumon |
|
|
Avelumab (Bavencio™) |
Carcinome de Merkel |
* agnostique : l'indication est indépendante de la localisation et de l’histologie tumorales mais dépend d'une anomalie génique. Le diagnostic s’appuie sur un test compagnon réalisé grâce à différentes techniques.
Les indications thérapeutiques homologuées
| Cible |
Médicament |
Indications homologuées |
|---|---|---|
| CTLA-4 |
Ipilimumab une perfusion toutes les 3 semaines - 4 au total |
Mélanome avancé (non résécable ou métastatique), monothérapie ou en association avec le nivolumab - une perfusion toutes les trois semaines - 4 au total Cancer du rein avancé de pronostic intermédiaire/défavorable, association avec le nivolumab en première ligne |
| PD-1 |
Nivolumab Une perfusion toutes les 2 semaines |
Mélanome
Cancer bronchique non à petites cellules localement en monothérapie (seconde ligne) Cancer du rein
Lymphome de Hodgkin en rechute ou réfractaire après une greffe de cellules souches autologue et un traitement par brentuximab vedotin (monothérapie) Cancer épidermoïde de la tête et du cou en rechute ou métastatique, en progression (seconde ligne - monothérapie) Carcinome urothélial localement avancé non résécable ou métastatique seconde ligne - monothérapie) Cancer épidermoïde de l'œsophage |
|
Pembrolizumab Une perfusion toutes les 3 semaines |
Mélanome avancé (non résécable ou métastatique) en monothérapie
Lymphome de Hodgkin en rechute ou réfractaire après échec d’une greffe de cellules souches autologue et d’un traitement par brentuximab vedotin, ou inéligibles à une greffe et après échec d’un traitement par brentuximab (monothérapie) Carcinome urothélial localement avancé ou métastatique ayant reçu une chimiothérapie antérieure à base de sels de platine ; ou inéligibles à une chimiothérapie à base de cisplatine et dont les tumeurs expriment PD-L1 avec un score positif combiné ≥ 10 (monothérapie) Carcinome hépatocellulaire en monothérapie après échec d'un traitement par le sorafénib |
|
|
Cemiplimab |
Carcinome épidermoïde cutané métastatique ou localement avancé chez des patients non candidats à une chirurgie ou à une radiothérapie à visée curative Carcinome basocellulaire Cancer bronchopulmonaire non à petites cellules en monothérapie en première ligne |
|
| PD-L1 |
Atezolizumab Une perfusion toutes les 3 semaines |
Cancer du sein avancé
|
|
Durvalumab Une perfusion toutes les 2 semaines |
Cancer du poumon non à petites cellules, stade III non opérable, ECOG 0 ou 1, dont la maladie n’a pas progressé après chimio-radiothérapie concomitante à base de platine (monothérapie) et positif pour PDL1 | |
|
Avelumab Une perfusion toutes les 2 semaines |
Carcinome de Merkel métastatique, dont la maladie a progressé après avoir reçu au moins une ligne de chimiothérapie antérieure (monothérapie) Cancer de la vessie |
Ce qu'il faut retenir de ces traitements
Bénéfice clinique majeur chez environ 30 % des patients
Bénéfice prolongé dans le temps
Mais peut être décalé dans le temps et être associé à des "pseudo-progressions"...
Thérapies très onéreuses
Ce n'est pas une panacée ! Actifs, actuellement, uniquement sur certains types/sous-types de cancers
Mise à jour
14 mai 2023

