Les médicaments de thérapie innovante (MTI)
Les CAR-T
Ce sont des lymphocytes T humains génétiquement "manipulés/OGM" pour exprimer à leur surface un récepteur chimérique reconnaissant un antigène (Chimeric Antigen Receptor) ou CAR.
Ces thérapies appartiennent à une nouvelle catégorie de médicaments dénommés "médicaments de thérapie innovante" (MTI), et définis dans le règlement européen 2007-1394.
Ces nouvelles thérapies innovantes appartiennent à une sous-catégorie qui est constituée par les médicaments de thérapie génique, parce que l’efficacité des CAR-T est supportée par la séquence d’ADN recombinant qui a été introduite dans les lymphocytes T pour les rendre "actifs" sur le plan thérapeutique.
L'immunothérapie adoptive
LES PREMIÈRES APPLICATIONS
Les lymphocytes T représentent les principaux acteurs de la lutte contre les cellules tumorales. L’immunothérapie adoptive consiste à administrer une source de lymphocytes T spécifiques d'un antigène donné, le plus souvent après expansion de ces cellules in vitro.
A son origine, elle consiste en un recueil de lymphocytes du patient à traiter. Les lymphocytes du patient, ex vivo , sont sélectionnés puis éduqués contre les antigènes choisis et enfin amplifiés. Ces lymphocytes "éduqués" sont réinjectés au patient. Les lymphocytes réinjectés sont par la suite souvent stimulés par des injections d’IL-2.
LES NOUVELLES MÉTHODES UTILISABLES
Pour exploiter l'effet antitumoral des lymphocytes T dans le traitement des cancers plusieurs nouvelles stratégies sont en développement :
- L’administration de lymphocytes T spécifiques d’antigènes tumoraux infiltrant les tumeurs (TIL)
- La création de lymphocytes T transgéniques obtenus par clonage moléculaire du récepteur des lymphocytes T (TCR) en cours de développement
- La création à partir de lymphocytes T, des lymphocytes T exprimant un récepteur chimérique composé de chaines d'immunoglobulines (CAR - récepteur antigénique chimérique) : CAR-T
Les lymphocytes T avec des récepteurs antigéniques chimériques (TCR)
LE RATIONNEL
L’utilisation de lymphocytes T autologues, c’est-à-dire du patient lui-même, capables de reconnaître spécifiquement les cellules tumorales est une nouvelle option thérapeutique prometteuse.
La mise au point de ces thérapeutiques a été de transformer des lymphocytes T du patient en médicament "vivant".
LES TCR TRANSGÉNIQUES
Le principe
Cette nouvelle technologie consiste à réinjecter des lymphocytes T, préalablement prélevés chez le patient, auxquels le récepteur cellulaire "T" (TCR) a été modifié génétiquement. Cette manipulation génétique permet d’intégrer, par transduction dans les lymphocytes T du patient, un gène codant pour un récepteur T spécifique d’un antigène tumoral.
Son intérêt
L’avantage majeur de cette technologie est de pouvoir utiliser des lymphocytes T du sang périphérique, donc faciles à prélever. Ainsi génétiquement modifiés, ces lymphocytes T transgéniques peuvent reconnaître des antigènes tumoraux.
Un des inconvénients est qu'ils sont HLA spécifiques et qu'un groupage tissulaire est nécessaire avant le processus de production.
LA STRUCTURE DU CAR-T
Un CAR est un récepteur chimérique composé de 3 domaines
- Le récepteur chimérique porte les signaux d’activation, via le domaine de signalisation CD3 et l’expression des molécules de co-stimulation. Les signaux sont déclenchés dès la reconnaissance directe de la cible antigénique par le fragment variable (scFv) de l’Ig reconnaissant spécifiquement l’antigène tumoral cible.
- Un domaine transmembranaire
- Une partie intracellulaire du récepteur permet l'activation du lymphocyte, après reconnaissance de l’antigène et la production de cytokines visant à détruire la cellule tumorale ainsi que l'expression de récepteurs de cytokines permettant la prolifération des CAR-T
L'ACTIVATION
L’activation est amplifiée par la libération de cytokines inflammatoires liée à la lyse tumorale et l’activation des cellules présentatrices d'antigènes (cellules dendritiques ou CPA) et des monocytes/macrophages.
L'effet collatéral attendu de cette activation est le risque de créer un syndrome de relargage cytokinique (CSR) - voir plus bas.
Les CAR T (chimeric antigen receptor)
LE PRINCIPE
Les CAR T-cells (Chimeric Antigen Receptor)
Ce sont des lymphocytes T prélevés du patient, puis modifiés génétiquement en laboratoire de manière à leur faire exprimer un récepteur artificiel, dit chimérique (CAR). Ce récepteur (CAR) est conçu de telle manière que sa partie extra-cellulaire reconnaisse un antigène tumoral, le plus spécifiquement possible afin d’éviter les effets néfastes sur d’autres organes du patient.
Les lymphocytes T avec des récepteurs antigéniques chimériques "CAR" ont l’avantage de ne pas être HLA restreints, c'est à dire qu'ils peuvent être appliqués à de plus larges populations de patients de groupes tissulaires différents.
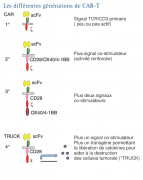
Les différentes générations de CAR T-cells, c'est compliqué !
Ils sont la résultante de la fusion entre le domaine intracellulaire du récepteur du lymphocyte T (TCR) (CD3 et CD28) avec le domaine de liaison extra cellulaire d’un fragment isolé d’une chaîne variable d’un anticorps qui reconnait un antigène tumoral. Ils associent ainsi la spécificité d’un anticorps (lymphocyte B) et l’activité cytotoxique d’un lymphocyte T. Pour être efficace, les antigènes reconnus par des lymphocytes T CAR doivent être exprimés à la surface de la cellule tumorale. L’ajout de domaines de costimulation augmente la prolifération et la survie des cellules ainsi modifiées.
LEUR UTILISATION POUR LE TRAITEMENT DE CERTAINES LEUCÉMIES EST VALIDÉE
La cible, la protéine CD19
Les cellules CAR-T ciblent le CD19 qui est un antigène de surface de certains lymphocytes de type B. La partie intracellulaire va, elle, se charger de l’activation des lymphocytes après fixation sur les cellules leucémiques. Plus récemment, l'antigène de maturation des lymphocytes B (BCMA) a été ciblé.
Les premiers résultats
Ces constructions sont utilisées dans le traitement des leucémies lymphoïdes chroniques (LLC), des leucémies aiguës lymphoblastiques (LAL) et certains lymphomes non-hodgkiniens à cellules B (NHL).
Les résultats obtenus sont très encourageants avec des taux de réponses globaux de 80% dans les LAL et de 40-50% dans les LLC et des réponses complètes durables (> 3 ans).
Plus récemment, des études dans les myélomes multiples réfractaires ont montré l'intérêt de cette approche thérapeutique.
Des résultats durables
Les deux premiers malades traités pour des leucémies incurables en échec thérapeutique, il y a plus d'une décennie, sont encore vivants !
LES MÉDICAMENTS HOMOLOGUÉS
LES CAR-T CIBLANT LE CD19
Ce CAR-T ciblant le CD19 est homologué pour le traitement :
- De la leucémie aiguë lymphoblastique (LAL) de type B réfractaire aux autres traitements chez en rechute/réfractaire chez l’enfant et le jeune adulte
- Du lymphome diffus à grandes cellules B en rechute ou réfractaire après la deuxième ligne ou plus d’un traitement systémique
Cette thérapeutique bénéficie, en France d'une ATU nominative.
Yescarta™ (axicabtagene ciloleucel)
Ce CAR-T est homologué pour le traitement du lymphome B de haut grade et du lymphome primitif à cellules B du médiastin en rechute/réfractaire (2ème ou 3ème ligne) exprimant la protéine de surface CD19+. Son indication a été étendue au traitement des lymphomes diffus à grandes cellules et en deuxième ligne de traitement.
Breyanzi™ (lisocabtagene maraleucel)
C'est aussi un CAR-T ciblant par son récepteur le CD19.
Il est homologué pour le traitement des lymphome diffus B en rechute ainsi que pour les patients atteints d’un myélome multiple en rechute/réfractaire (MM R/R) ayant déjà reçu au moins quatre lignes de traitement.
Il vient d'être homologué pour le traitement des lymphomes diffus B en rechute ainsi que pour les patients atteints d’un myélome multiple en rechute/réfractaire (MM R/R) ayant déjà reçu au moins quatre lignes de traitement.
Tecartus™ (brexucabtagene autoleucel)
C'est un CAR-T (Chimeric Antigen Receptor) ciblant le CD19.
Il est homologué pour le traitement des formes réfractaire ou en rechute de l'adulte du lymphome à cellules du manteau (LCM) et des leucémies aiguës lymphoblastiques B de l’adulte en rechute ou réfractaires
LES CAR-T CIBLANT LE BCMA
Abecma™ (idecabtagene vicleucel)
C'est un CAR-T anti-BCMA autologue homologué sur la base de l’essai KarMMA.
Il est indiqué pour le traitement du myélome multiple en rechute et réfractaire ayant reçu au moins trois traitements antérieurs, incluant un agent immunomodulateur, un inhibiteur du protéasome et un anticorps anti-CD38 (daratumab), et dont la maladie a progressé pendant le dernier traitement.
Carvykti™ (ciltacabtagene autoleucel)
C'est une immunothérapie par lymphocytes T autologues, génétiquement modifiés, dirigés contre le BCMA, qui implique la reprogrammation des propres lymphocytes T d'un patient avec un transgène codant un récepteur antigénique chimérique (CAR) qui identifie et élimine les cellules qui expriment le BCMA.
Le BCMA est principalement exprimé à la surface des cellules de la lignée B du myélome multiple malin, ainsi que des lymphocytes B et des plasmocytes à un stade avancé de leur développement.
La protéine CAR présente deux anticorps à domaine unique ciblant le BCMA conçus pour conférer une grande spécificité contre le BCMA humain.
Cette immunothérapie est indiquée pour le traitement du myélome multiple récidivant et réfractaire aux traitements (après au moins trois traitements antérieurs, notamment un agent immunomodulateur, un inhibiteur du protéasome et un anticorps anti-CD38), et dont la maladie s’est aggravée depuis le dernier traitement.
Le traitement consiste en une dose unique pour perfusion contenant une dispersion de cellules T viables CAR-positives dans une poche de perfusion. La dose cible est de 0,75 x 106/kg lymphocytes T viables CAR-positif.
EN RESUME
| CAR-T | Cible | Indication |
|---|---|---|
| Tisagenlecleucel Kymriah™) |
CD19 |
Leucémies aiguës lymphoblastiques de type B |
| Axicabtagene ciloleucel (Yescarta™) |
CD19 |
lymphome B de haut grade |
| Brexucabtagene autoleucel (Tecartus™) |
CD19 |
Lymphome du manteau en rechute |
|
Isocabtagene maraleucel |
BCMA |
Lymphomes B diffus à grandes cellules en rechute |
|
Ciltacabtagene autoleucel |
BCMA |
Myélome multiple en 4ème ligne |
Le parcours de soin compliqué !
LE PARCOURS DU "MEDICAMENT"
Etape 1 éligibilité
Vous serez pris en charge à l’hôpital par un centre expert. Il y en a 13 répartis dans toute la France dans les villes où il y a un CHU.
Pour être éligible, il faut être bon état général, et la décision sera conditionnée selon certains critères principaux, dont :
- L’absence de contre-indications liées à des pathologies déjà existantes
- L’absence d’infections actives
- L’histoire de la maladie
Une réunion composée de médecins de différents services (médecins greffeurs, spécialistes d’organes, hématologues, cancérologues) est planifiée pour chaque patient pouvant potentiellement être pris en charge par les cellules CAR T. Cette même équipe pluridisciplinaire est également chargée d’assurer le suivi, la sécurité et l’évaluation de la réponse au traitement pour chaque patient. Chaque demande est analysée et étudiée.
L’éligibilité du patient sera confirmée après certains examens réalisés, suivis de plusieurs entretiens, afin de bien appréhender le parcours patient et de ses risques.
Etape 2 leucaphérèse
C'est une technique de séparation des différentes cellules du sang circulant grâce à une technique de filtration utilisant une machine appelée séparateur de cellules.
L’appareil permet de prélever les globules blancs qui seront collectés dans une petite poche dont le volume final varie entre 1 000 et 1 750 mL, et qui serviront à la fabrication du médicament CAR-. Il s’agit d’un acte indolore, et la durée de la collecte ne dépasse pas 5 heures. Les deux bras sont connectés au séparateur pendant toute la durée du recueil et en continu.
Avant la collecte, le patient a un rendez-vous de consultation avec l’unité d’aphérèse pour évaluer son état veineux, et lui expliquer cette technique de prélèvement.
Etape 3 Contrôles de qualité Hôpital centre expert
À la suite de l’étape de leucaphérèse, l’échantillon prélevé est transmis à l’Unité fonctionnelle de Thérapie Cellulaire (UTC) pour vérifier la qualité du prélèvement.
Etape 4 envoi du prélèvement vers un établissement pharmaceutique
Le prélèvement est alors envoyé à un laboratoire pharmaceutique qui transformera ensuite génétiquement les cellules contenues dans le prélèvement en un médicament. Le prélèvement peut être envoyé soit à l’état frais, soit cryo-préservé.
Etape 5 Renvoi et stockage à l'hôpital centre expert
Les cellules CAR T préparées sont ensuite renvoyées à l’hôpital centre expert, au service de la pharmacie hospitalière et stockées à -196°C. Le traitement est sous la responsabilité du pharmacien de la pharmacie à usage intérieur (P.U.I).. Les cellules CAR T seront ensuite administrées.
La durée estimée entre le prélèvement des globules blancs du patient et le retour du médicament en cellules CAR T est de 4 à 5 semaines.
LE PARCOURS DE SOIN PROPREMENT DIT
Étapes préliminaires |
Phases de traitement |
|---|---|
|
1ère consultation avec l'hématologue ; enregistrement et commande du produit; consultation avec l'infirmière assurant la coordination |
J0 administration du CAR-T |
Les examens du parcours de soin
|
Etapes |
Contenu |
|---|---|
|
Indication de traitement |
LAL-B : myélogramme, immunophénotypage (CD19) |
|
Avant leucaphérèse |
Bilan biologique |
|
Avant hospitalisation |
LAL-B : myélogramme |
|
Après hospitalisation |
À chaque consultation : examen clinique neurologique, bilan biologique à 1 mois, 3 mois, 6 mois, 9 mois, 1 an |
Trois types spécifiques d’effets indésirables impliquant une surveillance attentive
Le syndrome de relargage des cytokines (CRS)
Il survient généralement durant la première semaine suivant la perfusion des cellules CAR-T et peut durer jusqu’à 7 jours. Il est déclenché par le relargage de cytokines pro-inflammatoires par les cellules T activées, en particulier de l'interféron (l’IFNγ) et de l’interleukine (IL6)-.
Les symptômes sont de la fièvre, une hypotension, une tachycardie, des frissons, la possibilité de troubles du rythme cardiaque.
La prévention de cet effet indésirable fait appel d'anticorps monoclonaux dirigés contre l'IL6, tel que le tocilizumab (Roactermra™).
Le traitement repose sur l’administration d’antalgique, antipyrétique, d’hydratation (sérum physiologique ou cristalloïdes) voire de corticoïdes, ou du tocilizumab (anticorps monoclonal ciblant le récepteur de l’IL6).
La neurotoxicité (ICANS pour "immune effector cell-associated neurotoxicity syndrome")
Elle est fréquente et toucherait plus de la moitiés des patients traités. Elle survient dans les jours suivants l’administration de CAR-T.
Les symptômes sont des troubles de la parole (aphasie), une confusion, de la somnolence voire un coma ou des convulsions.
Le traitement consiste en l’administration de corticoïdes et/ou tocilizumab (Roactermra™). un anticorps monoclonal humanisé qui bloque l’action des récepteurs de l’IL-6.
Cet effet indésirable peut durer environ deux semaines.
Une aplasie touchant les lymphocytes B
La protéine CD19 est exprimé à la membrane des cellules B normales pratiquement tout au long du processus de différenciation. En revanche, le CD19 n’est pas exprimé à la surface des cellules souches hématopoïétiques et son expression est fortement diminuée ou perdue au stade de plasmocyte.
Le traitement par des CAR-T ciblant CD19 induit une hypogammaglobulinémie et une aplasie B qui témoigne de la persistance in vivo des cellules CAR-T. Heureusement, les plasmocytes sont en partie épargnés, et on observe une persistance partielle de l’immunité humorale.
Les infections
Elles sont très fréquentes après un traitement par CAR-T cells. Le risque d’infection est lié au cancer et aux traitements antérieurs, notamment les différentes lignes de chimiothérapie, la corticothérapie, les greffes de moelle osseuse. De plus, ce type de traitement par les CAR-T induit une immunodépression, avec une diminution marquée et souvent prolongée des neutrophiles (neutropénie) ainsi qu'une lymphopénie
La fréquence et le type d’infection dépendent de la période par rapport à la réinjection post-CAR-T des cellules. La majorité des infections survient dans les 30 jours. Durant le premier mois, les infections sont surtout bactériennes et virales respiratoires, les infections fongiques peuvent survenir chez les patients à risque .
L'environnement...
Les CAR-T sont des organismes génétiquement modifiés (OGM), ce qui implique un suivi à long terme des patients pour améliorer les connaissances sur le profil de sécurité d’emploi en particulier virologique des cellules CAR-T.
Symptômes et grades du CRES (CAR-T cell-related encephalopathy syndrome)
|
Score CARTOX-10 |
G1 7–9 |
G2 3–6 ( modérée) |
G3 0–2 |
G4 état critique |
|---|---|---|---|---|
|
Augmentation de la pression intracrânienne (PIC) |
0 |
0 |
Œdème papillaire |
Œdème papillaire |
|
Convulsions |
0 |
0 |
Crise convulsive/épilepsie partielle |
Crises convulsives généralisées |
D’autres innovations possibles
LES NOUVELLES GÉNÉRATIONS DE CAR-T
Elles consistent en des améliorations structurelles dont l’objectif est d’amplifier l’activité thérapeutique.
- Le renforcement de l’activation lymphocytaire par injection d’interleukine 2 (IL-2), seule ou associée.
- L’éducation, puis réinjection des cellules dendritiques, après leur mise en contact in vitro avec des peptides tumoraux ou des fragments de cellules tumorales en voie de destruction (apoptosomes)
- L’injection sous cutanée d’exosomes (fragments membranaires provenant des cellules dendritiques en culture activées par l’antigène tumoral).
Ces modalités font l’objet de recherches cliniques de phase 2 ou 3.
LES CAR-T ALLOGENIQUES (UCAR-T)
Des cellules CAR-T allogéniques, produites à partir des lymphocytes T d’un donneur, sont aussi en développement et certaines d’entre elles pourraient permettre de standardiser la production et l’emploi de ces thérapies (« cellules CAR-T universelles »).
Les premiers résultats de ce type d'approche sont très encourageants dans le traitement du lymphome de Hodgkin.
LES CAR-NK
Les cellules NK sont des lymphocytes spécialisés dans la lyse cellulaire. Ils possèdent un rôle important dans la réponse immunitaire innée, non dépendante d’antigènes, contre les cellules infectées et tumorales.
Ils ne produisent pas de cytokines en quantité importante après activation ce qui limiterait le risque de syndrome de relargage cytokinique (CRS).
Ils auraient un potentiel cytolytique plus maitrisé par une meilleure balance entre des signaux inhibiteurs transmis par les récepteurs reconnaissant des molécules d'histocompatibilté de HLA de classe I* autologues dont l’expression peut être altérée sur les cellules tumorales et des ses signaux activateurs médiés notamment par NKG2D reconnaissant les molécules de stress MICA/MICB surexprimées sur de nombreuses cellules tumorales
Mise à jour
28 novembre 2023

