Une prolifération cellulaire hors de contrôle !
Comment les spécialistes voient le cancer....
DEUX PIONNIERS...
1950 I. Berenblum
Ce chercheur montra que la cancérogenèse comportait au moins deux étapes, l’initiation et la promotion (Br J Cancer. 1947 Dec; 1(4): 383–391). On en a, depuis, identifié une troisième, la progression.
1954 P. Armirage et R. Doll
Ces deux scientifiques ont conceptualisé ce processus dans l'article princeps "The age distribution of cancer and a multi-stage theory of carcinogenesis. (Br. J. Cancer 1954;8:1–12).
A PARTIR DE CES DÉCOUVERTES...
Les tumeurs
Elles résultent d’un processus génétique pathologique somatique, dit multi-étapes, où des altérations génétiques successives s’accumulent dans diverses cellules et participent, soit par l’activation, soit par l’inactivation de gènes au processus qui transforme la cellule normale en cellules cancéreuses puis permet aux cellules cancéreuse de proliférer et de s’étendre au delà du tissu d’origine pour former des métastases.
L’histoire naturelle d’un cancer
Elle peut être divisée schématiquement en plusieurs étapes :
- La transformation cancéreuse d’une cellule
- L’expansion clonale de la cellule cancéreuse
- La croissance de la masse tumorale qui devient cliniquement détectable et l’invasion locale avec envahissement loco-régional par le tissu cancéreux
- La dissémination des cellules cancéreuses à distance du foyer tumoral initial et la formation de foyers tumoraux secondaires, les métastases.
Les états précancéreux (OMS)
LES CONDITIONS PRÉCANCÉREUSES
Ce sont des maladies associées à un risque significativement élevé de survenue de cancer.
LES LÉSIONS PRÉCANCÉREUSES
Ce sont des anomalies de la structure des tissus. Si elles persistent suffisamment longtemps, elles peuvent aboutir à l'apparition d'un cancer.
LES DYSPLASIES
Le terme "dysplasie"
L’étymologie du mot dysplasie vient du grec, dys (anomalie) et de platein (construire). Ce sont des troubles acquis de l’homéostasie (équilibre) cellulaire résultant d’anomalies génétiques qui altèrent le contrôle de la prolifération et la maturation cellulaire.
Les dysplasies ne sont décrites que dans les épithéliums (col utérin, tube digestif, voies aériennes, glande mammaire, voies urinaires…). Ce sont des lésions précancéreuses car les cellules dysplasiques peuvent parfois et dans un délai très variable, se transformer en cellules cancéreuses par accumulation d’autres anomalies génétiques.
Les états dysplasiques précancéreux
Ils peuvent être observés dans de nombreuses conditions
- Au cours d’un état inflammatoire chronique, comme par exemple au décours d'une gastrite chronique à Helicobacter pylori ; d'un endo-brachy-œsophage (muqueuse de Barrett) par reflux acide chronique ; certaines maladies inflammatoires chroniques intestinales, comme les colites inflammatoires (rectocolite ou maladie de Crohn
- Lors d’infections virales, comme par exemple les infections à Papillomavirus du col utérin
- Dans des tumeurs bénignes, comme dans les polypes du côlon
Tumeur bénigne versus tumeur maligne
|
Tumeur bénigne |
Tumeur maligne |
|---|---|
|
Bien limitée |
Mal limitée |
|
Encapsulée |
Non Encapsulée |
|
Semblable au tissu d’origine |
Plus ou moins semblable au tissu d’origine |
|
Pas de destruction des tissus voisins |
Envahissement des tissus voisins |
|
Cellules régulières |
Cellules atypiques |
|
Croissance lente |
Croissance rapide |
|
Pas de récidive locale ; pas de métastase |
Récidive possible ; métastase possible |
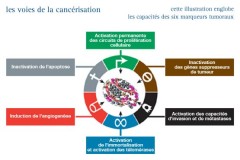
Un processus en plusieurs étapes ...
LA PHASE INITIALE (MOLÉCULAIRE)
Les premières altérations qui initient la tumorigenèse sont parfois héritées...
Les porteurs de l’anomalie dans la famille sont prédisposés à la survenue d’un cancer. Ces formes familiales sont rares, généralement transmises sur mode dominant et à forte pénétrance.
Cette ou ces anomalies génétiques sont incapables, à elles seules, de transformer une cellule normale en une cellule cancéreuse. Cependant, elles réduisent le nombre de phénomènes acquis nécessaires à l'acquisition d'un phénotype de cellule maligne.
Les formes sporadiques, qui représentent la majorité des cancers....
Les premières altérations qui initient la transformation tumorale apparaissent dans différents tissus au cours de la vie. Les différentes étapes de la carcinogenèse peuvent être initiées ou favorisées par des facteurs endogènes : hormonaux, immunitaires ainsi que par des facteurs exogènes ou environnementaux
L’impact de ces facteurs varie d’un individu à l’autre en fonction d’un profil génomique qui le rend plus ou moins susceptible à ces facteurs et par conséquence au cancer.
LA PHASE INFRACLINIQUE
L'étape d'initiation
Elle aboutit à l'acquisition, par une cellule, d'un phénotype de cellule maligne. Il s'agit d'une étape acquise par action sur le génome de la cellule d'agents comme des carcinogènes qui sont initiateurs, c'est-à-dire mutagènes et/ou des co-carcinogènes qui agissent comme des promoteurs mais qui ne sont pas, en tant que tels, mutagènes mais agissent comme des facteurs favorisant la croissance cellulaire
L'étape de promotion
C'est l'émergence d'un phénotype cellulaire tumoral indépendant des contrôles tissulaires. Cette étape accompagne la progression tumorale initiale qui est d'abord lente puis exponentielle.
LA PHASE CLINIQUE
Elle apparaît lors du développement de plus 109 cellules tumorales ce qui représente une lésion de 1 g qui est alors visible en imagerie médicale.
Une progression métastatique apparaît après une première phase d'invasivité locale. Le phénomène métastatique résulte de multiples étapes toutes limitantes.
LA PHASE MÉTASTATIQUE
Elle est le résultat d'un échappement thérapeutique. Les cellules tumorales sont caractérisées par une autonomie de croissance, une adaptabilité métabolique cellulaire et l'acquisition de caractéristiques les rendant pharmaco-résistantes.
Le cancer, en 2023, c'est...
Une prolifération cellulaire anarchique et non contrôlée
Une perte d’adhérence et capacité de prolifération (clonogénicité) en milieu semi liquide
Une perte de la dépendance aux facteurs de croissance
Une perte de la sénescence (télomères, hTERT)
⇓
Survie, invasion, angiogenèse, métastases, instabilité génétique....
Première étape de la cancérisation : l'initiation
LES THÉORIES
Le modèle aléatoire (stochastique) d’évolution clonale
Ce modèle suppose que chaque cellule cancéreuse a la capacité de former un clone tumorigène. L’initiation tumorale et sa progression résulteraient de l’acquisition séquentielle de mutations qui sont à l’origine de la formation de clones. Outre les facteurs intrinsèques de la cellule (ses mutations), les facteurs extrinsèques (environnement tumoral, traitements) auraient un rôle dans la sélection clonale.
Le modèle hiérarchique
Il se différencie du modèle aléatoire par le fait que toutes les cellules tumorales ne seraient pas équivalentes fonctionnellement. Une seule cellule, la cellule souche cancéreuse (exprimant la protéine CD44+ et de l’ALDH), serait tumorigène alors que toutes les autres cellules tumorales (non-cellules souches cancéreuses) seraient, elles, incapables d’initier et de propager la tumeur.
Ce modèle est dit hiérarchique car la cellule souche cancéreuse se place au sommet de la pyramide de différenciation tumorale. La cellule souche cancéreuse posséderait des propriétés des cellules souches adultes multipotentes :
- L'auto-renouvellement afin de maintenir le réservoir de cellules souches cancéreuses
- La possibilité de différenciation en donnant naissance à l’ensemble des cellules tumorales
Le modèle des cellules souches cancéreuses est unidirectionnel : les cellules souches cancéreuses engendrent les non-cellules souches cancéreuses alors que les non-cellules souches cancéreuses sont incapables de générer des cellules souches cancéreuses.
Le modèle hiérarchique d’évolution clonale
C'est la synthèse des deux premiers modèles. Des travaux expérimentaux ont montré que les cellules souches cancéreuses constituent une population hétérogène de cellules présentant une diversité génétique responsable de l’organisation oligoclonale de la tumeur.
Les cellules souches cancéreuses acquièrent de nouvelles mutations qui peuvent favoriser l’auto-renouvellement et/ou altérer le pouvoir différenciant de certaines sous-populations de cellules souches cancéreuses.
Ainsi, au cours de la progression tumorale, des nouvelles mutations peuvent conférer un avantage prolifératif à certaines sous-populations de cellules souches cancéreuses.
LE PROCESSUS
Le stress oxydatif et l'ADN
Les principaux agents endogènes cellulaires sont les espèces actives de l’oxygène formées dans les cellules lors de la combustion de l’oxygène.
Il y a environ trois milliards d’années, l’utilisation de l’oxygène comme source d’énergie (celle-ci est dégagée quand l’oxygène se lie au carbone pour former le gaz carbonique) par les organismes aérobies a constitué un progrès dans l’histoire de la vie. Cependant, l’oxygène est un agent très dangereux car si environ 95 % de l’oxygène est utilisé pour fabriquer du CO2, 5 % forment des radicaux oxydatifs (radicaux libres) puissants, susceptibles de léser toutes les molécules présentes dans une cellule, notamment l’ADN.
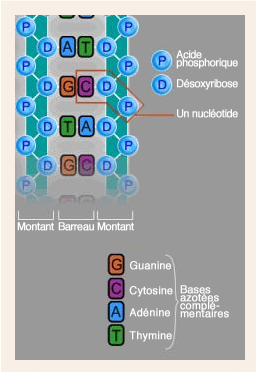
L'ADN est une molécule longue et étroite, très fragile.
Les radicaux libres créent, chaque jour, environ 10 000 lésions de l’ADN dans chacune des 6 × 10 13 cellules de l’organisme.
Les variations épigénétiques
L’initiation peut être aussi causée par un phénomène épigénétique, notamment la méthylation. La méthylation consiste en la fixation d’un groupe méthyle sur une cytosine, ce qui modifie sa signification dans le code de l’ADN. Si cette méthylation touche une cytosine située dans le segment d’ADN qui contrôle l’expression d’un gène, cette méthylation peut rendre ce gène silencieux.
La transformation d'un proto-oncogène en oncogène ou l'inactivation d'un gène suppresseur de tumeur...
Que l’initiation soit due à une mutation ou un effet épigénétique, elle est généralement liée à la transformation d’un proto-oncogène en oncogène ou à l’altération de la fonction d’un gène suppresseur de tumeur.
Cette "initiation" confère à la cellule la capacité de se multiplier de façon autonome, mais cette potentialité peut rester très longtemps inapparente car elle ne s’exprime que quand d’autres lésions sont apparues dans la cellule initiée au cours de la seconde étape (promotion) qui est le résultat de l’action de promoteurs lesquels soit stimulent la prolifération cellulaire, soit altèrent la signalisation entre cellules.
LA MUTATION
Le contexte
Au cours de l'évolution les organismes vivants ont sélectionné et maintenu de nombreux systèmes de défense pour se prémunir de la survenue de cancers car, le code génétique est porteur d'une information favorable à la survie de l'espèce qui doit, de ce fait, être maintenu fidèlement lors de la réplication de l'ADN.
Le taux estimé de mutagenèse spontanée est de ce fait très faible, de l'ordre d'une base modifiée pour 10 milliards répliquées. Chez l'homme , ce taux signifie qu'une mutation apparaît en moyenne une fois au cours de trois divisions cellulaires.
De plus, sachant que plus de 90 % du génome n'est pas codant, que du fait de la sénescence cellulaire, en dehors des cellules souches, peu de cellules se divisent plus de 100 fois et que la mutation doit toucher les deux premières bases des codons, on voit que le système est très stable et que tout est fait pour éviter l'émergence de cellules mutées cancéreuses.
La suite des événements
Cette modification initiale, le plus souvent, est la conséquence de la mutation d’une ou de plusieurs bases de la double hélice d’ADN. Sous l'effet d'un agent initiateur, une base est soit remplacée par une autre, soit supprimée.
La plupart des mutations ont lieu dans les segments de l’ADN qui ne codent pour aucun gène, mais qui sont très spécifiques à chaque individu. De ce fait, cette mutation initiale n'a aucune répercussion biologique. Plus rarement, la mutation intéresse un gène utile pour la division cellulaire.
La cellule possède tout un matériel enzymatique destiné à réparer les mutations produites.
Pour lui permettre de bien réparer son matériel génétique, des gènes spécifiques contrôlent la parfaite intégrité de l’ADN transmis. Ceci explique la rareté des cancers, si on la compare aux nombres infinis de divisions cellulaires.
La réparation est impossible…
La réparation de l’ADN cellulaire n’est plus possible lorsqu’une mutation touche les gènes commandant les molécules réparatrices de l’ADN. C’est une étape importante dans la cancérisation. On retrouve une atteinte des gènes régulateurs dans la plupart des cancers humains, comme des mutations des gènes suppresseurs de tumeur, par exemple des mutations du gène p53 ou de la protéine du rétinoblastome pRb.
La réparation de l’ADN est impossible, mais n’est pas transmise…
Si la cellule n'a pas eu le temps, avant sa division (mitose), de réparer, l'anomalie, celle-ci n'est pas obligatoirement transmise aux cellules filles, car la cellule possède un dernier mécanisme de défense de la régularité de la transmission génétique qui est le suicide ou apoptose. Ainsi, la majorité des cellules anormales arrêtent la transmission d'un matériel génétique anormal.
Malgré tout, le cancer ne se développe pas facilement !
Pour chacune des étapes de la cancérisation, il existe des mécanismes de défense de l'organisme. Pour proliférer et entraîner la mort de l'organisme porteur, si aucun traitement n’est donné, il faut que les cellules cancéreuses acquièrent de nouvelles propriétés.
- Une indépendance vis-à-vis des facteurs de croissance pour leur mitose,
- Un accroissement significatif du nombre de mitoses,
- La perte de l'inhibition de contact,
- Des modifications des facteurs membranaires pour permettre à la cellule tumorale de se déplacer,
- Les propriétés destructrices locales ou de stimulation à leur profit des mécanismes normaux du remodelage,
- Le pouvoir métastatique.
L'absence d'une seule de ces propriétés peut entraîner l'arrêt du processus cancéreux.
UNE SEULE MUTATION N'EST PAS SUFFISANTE...
Si une seule mutation était suffisante pour induire l'apparition d'une tumeur maligne, chacun de nos gènes qui subit environ 10-6 mutations spontanées par division cellulaire, aurait, à raison de 10 16 divisions cellulaires dans une vie, 10 -6 x 10 16 = 10 10 fois l'occasion d’entraîner l'apparition d'une tumeur maligne, ce qui ferait de nous une espèce pratiquement non viable !
UNE ACCUMULATION DE PLUSIEURS MUTATIONS
L'apparition d'un clone cellulaire malin procède heureusement de l'accumulation dans une seule cellule d'évènements rares et non liés entre eux. Cette nécessité d'une succession dans le temps de multiples altérations cellulaires se reflète bien dans l'inégalité de fréquence de survenue d'un cancer en fonction de l'âge.
l’hypothèse de Knudson à partir du modèle du rétinoblastome
- Les gènes dont la fonction normale est de réguler la croissance cellulaire sont habituellement inactivés selon un mécanisme à deux étapes
- Une première copie du gène est inactivée (mutation ou modification du profil de méthylation)
- La seconde est délétée.
Deuxième étape de la cancérisation : la promotion...
UNE PROLIFÉRATION PLUS OU MOINS MAITRISÉE..
C’est la prolifération, plus ou moins contrôlée, des cellules initiées qui est le résultat d'une succession de modifications qui se déroulent à l’échelon cellulaire et que l’on ne peut toujours pas observer directement chez l'homme.
Les cancérogènes
Les études épidémiologiques confirment la responsabilité des substances cancérogènes chez l’homme, et démontrent une certaine similitude des mécanismes responsables des cancers à travers les espèces. Mais, à eux seuls, la plupart des agents initiateurs ne sont pas capables de provoquer un cancer.
Au fil des divisions cellulaires, l'accumulation d'anomalies sur différents gènes procure un avantage sélectif au clone (groupe) de cellules tumorales. Les cellules cancéreuses deviennent alors de plus en plus agressives pour leur environnement et échappent progressivement à tout contrôle.
Les facteurs de promotion
L'agent promoteur va alors exercer son action pendant de nombreuses années en facilitant la multiplication des cellules initiées. Au cours d'une des divisions ultérieures, une nouvelle mutation ou une nouvelle initiation aura lieu augmentant encore le dérèglement précédent. Parmi les facteurs de promotion reconnus, on peut citer :
- La nutrition
- Des substances toxiques
- Les infections chroniques
- Les traumatismes répétés
- Les hormones pour certains cancers dits hormonodépendants comme les cancers du sein, de la prostate, du corps de l'utérus, de la thyroïde, etc.
- L'âge car il correspond à un nombre important de divisions cellulaires et parce que les mécanismes de réparation deviennent probablement moins efficaces
LA TRANSITION ÉPITHÉLIO-MÉSENCHYMATEUSE (EMT)
Elle est définie comme le processus au cours duquel une cellule épithéliale :
- Acquiert un phénotype invasif, fibroblastoïde
- Diminue l’expression de protéines spécifiquement épithéliales et exprime des protéines spécifiquement mésenchymateuses (vimentine, N-cadhérine, etc.)
- Dégrade et migre à travers la matrice extra-cellulaire (MEC)
Un phénomène normal
C'est un processus cellulaire qui intervient dans plusieurs phases du développement embryonnaire normal, notamment au stade de blastula par la formation du mésoderme lors de la gastrulation.
En cas de cancer...
Compte tenu des propriétés migratoires des cellules mésenchymateuses, l’EMT pourrait être un moyen, pour les cellules tumorales épithéliales, d’acquérir un potentiel métastatique. Il a été ainsi rapporté dans de nombreux modèles que la progression tumorale vers un stade invasif et métastatique s’associe à une dédifférenciation cellulaire, avec altération de la polarisation et acquisition d’un morphotype fibroblastoïde.
LA PÉRENNISATION DE LA PROMOTION
Sous l'effet des agents initiateurs et promoteurs, des divisions cellulaires (mitoses) plus nombreuses et non contrôlées, vont se produire.
Un nombre important de ces mitoses aboutit à la mort de la cellule par apoptose, car le produit de la division irrégulière de l’ADN n'est pas viable. Cependant, du fait du nombre très important de mitoses, certaines cellules, dites initiées, acquièrent suffisamment d'indépendance pour proliférer en s'échappant au contrôle des facteurs de croissance.
LA PROLIFÉRATION CLONALE
Les cellules tumorales initiées acquièrent alors la propriété de s'auto-reproduire, sans contrôle de l'organisme. Ces proliférations non contrôlées donnent naissance à des clones cellulaires, tous issus de la même cellule, ayant acquis cette indépendance et pouvant, seuls, la transmettre.
L'apparition d'un clone cellulaire tumoral malin serait ainsi la conséquence d’une accumulation, dans une seule cellule, d'anomalies liées à des événements rares et non reliés entre eux. Cette nécessité d'une succession dans le temps de multiples altérations cellulaires se reflète bien dans l'augmentation de la fréquence des cancers en fonction de l'âge.
Les chercheurs estiment que 2 à 7 événements indépendants, non obligatoirement tous mutagènes, sont nécessaires pour entraîner la transformation d’une cellule normale en cellule maligne.
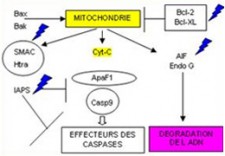
L'ATTEINTE DE L'APOPTOSE
L’apoptose c’est l’ensemble des phénomènes aboutissant à la mort naturelle de la cellule. Il existe deux voies d’activation de l’apoptose :
- La voie intrinsèque est sous la dépendance des mitochondries. Cette fonction est principalement régulée par la famille des protéines Bcl-2
- La voie extrinsèque fait intervenir des récepteurs de la membrane cellulaire, appelés récepteurs de mort (Death Receptors), les récepteurs TRAIL (TNF- Related Apoptosis-Inducing Ligand )
On distingue trois étapes successives
- L'induction qui peut être déclenchées par
- Des toxines, la cytotoxicité
- L'inhibition ou déplétion des stimuli de croissance
- L'engagement de récepteurs de surface spécifiques; les récepteurs dits de mort, TRAIL
- La régulation est effectuée par
- Les molécules de la famille bcl2
- Les inhibiteurs des enzymes de la famille des caspases
- L'exécution par la mise en œuvre d'enzymes protéolytiques de la famille des caspases
SA FONCTION …
L’apoptose permet de réguler finement l’équilibre entre naissance et disparition des cellules. Si cette fonction est altérée, elle entraîne, les anomalies suivantes :
- Une accumulation cellulaire
- Une longévité cellulaire
- Une instabilité génomique
- Une résistance à la surveillance immunitaire
- Une indépendance vis-à-vis de facteurs de croissance cellulaire
- L’induction d’une angiogenèse (résistance à l’hypoxie)
- L’apparition de métastases (survie cellulaire en situation isolée)
- La résistance aux thérapeutiques
LA CELLULE CANCÉREUSE
Elle développe des phénomènes de résistance à l’apoptose et tend à devenir "immortelle."
Une disparition de l'autophagie
UN PEU D'HISTOIRE
Le concept d'autophagie a été découvert dans les années 1960, par le Belge Christian de Duve (l'un des trois lauréats du Nobel de médecine en 1974). Ce chercheur a été l'un des premiers à observer la destruction par les cellules de leur propre substance en l'évacuant vers le lysosome.
La connaissance du phénomène est cependant restée limitée jusqu'aux travaux de Yoshinori Ohsumi qui, au début des années 1990, a mené des expériences à partir de levurse et identifié les gènes de l'autophagie . Ces découvertes lui valent, en 2016, le Prix Nobel de médecine et physiologie.
EN BREF...
C'est un mécanisme permettant à la cellule de digérer une partie de son contenu, que ce soit le cytoplasme, les protéines ou les organites cellulaires.
Les cellules "mourantes" libèrent des messages d’alerte, dont de l’ATP, recrutant ainsi les cellules immunitaires et permettant une réponse ciblée contre les cellules cancéreuses encore présentes. De fait, l’ATP libéré dans l'espace extracellulaire est responsable de l’attraction des cellules dendritiques (DC) qui sont les cellules présentatrices d'antigènes et que l'on qualifie de "sentinelles du système immunitaire". Les cellules dendritiques alertent et activent les lymphocytes T, qui sont alors capables de s’attaquer spécifiquement aux cellules tumorales restantes.
AUTOPHAGIE & CANCER
Les premières observations suspectant un rôle de l’autophagie dans le cancer ont montré que les cellules cancéreuses présentaient en général une capacité autophagique plus réduite que les cellules normales ce qui inhibe la libération d’ATP par les cellules tumorales mourantes et réduit donc l’efficacité thérapeutique au niveau immunitaire.
Résumons-nous...
| Principaux mécanismes potentiels de cancérogenèse |
|---|
|
LES CELLULES SOUCHES ET LES AUTRES ...
LES CELLULES SOUCHES
Définition
Une cellule souche est une cellule indifférenciée à longue durée de vie capable et possède deux propriétés spécifiques :
- L'auto-renouvellement (multiplication à l'identique pour produire de nouvelles cellules souches)
- La possibilité de se différencier en cellules matures (phénotypiques, morphologiques et fonctionnelles)
Les cellules souches cancéreuses
Elles ont été identifiées et isolées dans différentes tumeurs solides, comme par exemple dans les cancers du sein, du cerveau, du pancréas et du côlon. C'est une sous-population de cellules cancéreuses aussi appelées cellules initiatrices de tumeur. Elles expriment, le plus souvent, la protéine de surface CD 133+ et possèdent deux propriétés majeures des cellules souches que sont :
- L’auto-renouvellement, permet à une cellule souche de donner une cellule identique à elle-même et de maintenir ainsi le pool de cellules souches
- La différenciation va générer la masse tumorale qui prolifère très vite, l’ensemble régénérant la tumeur entièrement.
Ce que l'on sait...
L'instabilité génétique des cellules tumorales se traduit par l'acquisition par les cellules filles de nouvelles propriétés d'indépendance ou de nouvelles caractéristiques fonctionnelles. Ces cellules sont appelées les cellules souches qui possèdent trois propriétés spécifiques
Seules les cellules souches, ayant un pouvoir d'autoreproduction sont véritablement dangereuses dans la maladie cancéreuse car elles perpétuent le phénotype cancéreux.
LES AUTRES CELLULES
Elles se différencient vers des cellules plus ou moins proches des cellules normales et meurent par apoptose terminale. Dans une tumeur, ces cellules ne font que du volume mais ne sont pas très dangereuses .
L'IMPORTANCE DE CETTE NOTION...
Impliquées dans la résistance
Si le pourcentage de cellules souches tumorales ne représente qu’une très faible proportion de la masse tumorale, en raison de leurs différentes aptitudes à l’égard de la réparation de l’ADN et de leur faible potentiel de prolifération, les cellules souches cancéreuses sont à la source des phénomènes de résistance aux radiations ionisantes et à la chimiothérapie.
Mais aussi...
Les traitements qui réduisent le volume tumoral, ce qui correspond au concept de réponse clinique, ne guérissent le malade que s’ils font disparaître toutes les cellules souches de son organisme. Une réponse clinique est un résultat intéressant mais il n’est, malheureusement, pas obligatoirement synonyme de guérison...
Spécificités des cellules souches
|
Cellule souche |
Événement |
Résultat |
Tumeur |
|---|---|---|---|
|
Normale |
Mutation |
Cellule souche cancéreuse |
Primitive |
|
Tumeur primitive |
Chimiothérapie |
Cellule souche cancéreuse résistante |
Rechute |
|
Métastase |
Mutation |
Cellule souche cancéreuse de métastase |
Métastase |
Dernière étape : l’invasion tumorale
Destruction de la matrice extracellulaire péri-tumorale ⇒ perte des connections intercellulaires ⇒ développement d’une angiogenèse tumorale ⇒ développement d’un stroma tumoral
Comment les cellules tumorales s’attaquent-elles aux membranes basales ?
L'AUTONOMISATION CELLULAIRE
Le caractère autonome de la réplication cellulaire ne suffit pas à faire se développer un cancer….
Au cours des divisions cellulaires incontrôlées, certaines cellules vont alors être le lieu de mutations plus profondes. Elles vont perdre ou modifier leurs glycoprotéines de surface qui permettent la constitution d'un tissu bien organisé, Elles acquièrent, à ce stade, la propriété de dissoudre les membranes basales, soit par elles-mêmes soit par la stimulation des cellules avoisinantes soit, enfin, par la production d'enzymes permettant d’attaquer les structures des tissus comme les collagénases, les hydrolases lysosomales et l’activateur du plasminogène.
De plus, elles acquièrent une certaine mobilité ce qui leur permet de s'approcher des vaisseaux sanguins, puis pour certaines, de provoquer la sécrétion de facteurs de croissance des vaisseaux sanguins, comme le VEGF. Ce phénomène s’appelle l’angiogenèse. La stimulation de l’angiogenèse aboutit à la constitution d'un réseau de capillaires nourriciers indispensables à la prolifération.
L'invasion de la membrane basale
Elle constitue un phénomène majeur du développement du cancer. Cette étape modifie considérablement le pronostic. Dès l'invasion de la membrane basale, les mêmes mécanismes de pénétration des membranes vont être utilisés pour l'invasion des capillaires lymphatiques et sanguins. A partir de cette invasion, les cellules cancéreuses ont la capacité de s'établir à distance en retraversant la membrane des capillaires sanguins des organes distants. C'est ce qu'on appelle des métastases. Les métastases peuvent être ganglionnaires et/ou toucher des autres parties du corps.
LA PROGRESSION DANS UN ORGANE...
Les cellules cancéreuses qui ont remplacé les cellules normales du tissu, vont se multiplier, s'organiser, envahir les tissus avoisinants et entraîner un bouleversement de l'architecture de l'organe. Les remaniements du tissu de soutien (tissu conjonctif) entraînent une réaction particulière de ce dernier, appelée la « stroma-réaction ».
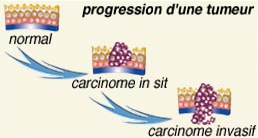
Les cancers « micro-invasifs »
Le clone tumoral érode la membrane basale et envahit la partie adjacente du tissu de soutien ou chorion. A ce stade, le cancer est appelé « micro-invasif ». Ces cancers invasifs, mais très superficiels, ont un pronostic bien meilleur que celui des cancers plus évolués de même type.
Les cancers « intra-muqueux »
La prolifération tumorale progresse ensuite dans la profondeur du tissu de soutien (chorion) de la muqueuse pour atteindre le tissu sous-jacent comme la sous-muqueuse colique, la musculeuse vésicale, l’hypoderme, la bronche. Dans le tube digestif, les cancers « intra-muqueux » envahissent le chorion muqueux sans franchir la couche musculaire muqueuse. Leur pronostic est plus favorable que celui des cancers ayant envahi les couches pariétales plus périphériques.
L’évolution ultérieure
De tissu en tissu, la prolifération envahit les différents constituants de l'organe, de proche en proche, par continuité. Les tissus normaux sont ainsi progressivement remplacés par la formation tumorale.
- Dans un organe plein comme le foie, le cerveau ou le rein, la prolifération forme une masse arrondie unique. C’est la tumeur qui est mise en évidence par l’examen ou l’imagerie médicale.
- Dans un organe creux, comme le tube digestif, elle envahit plus ou moins rapidement et successivement les différents plans de structure de l’organe : muqueuse, sous-muqueuse, musculeuse. Cette pénétration en profondeur de la tumeur permet de préciser le stade de l'extension du processus.
Les cellules tumorales peuvent alors envahir les vaisseaux (veines ou lymphatiques) ou les gaines nerveuses (cancer de la prostate, en particulier). Leur migration le long de ces axes peut être à l'origine de foyers tumoraux accessoires, formant des masses multiples dans l'organe intéressé.
Rôles de l'angiogenèse
- Indispensable à partir d’un volume de un à deux millimètres cubes
- Permet la croissance des cellules tumorales et l'augmentation de la taille de la tumeur
- Facilite la dissémination des cellules tumorales : les néovaisseaux seraient plus perméables aux cellules tumorales
- Facteur pronostic péjoratif dans nombreux cancers : estomac, sein, rein, sarcome, ovaire...
L’hétérogénéité intratumorale
UN CONSTAT...
L’hétérogénéité intratumorale est visible en microscopie. Les cellules cancéreuses au sein d’une même tumeur se caractérisent souvent par une diversité morphologique et une variabilité d’expression de marqueurs moléculaires.
Il existe, de fait, un certain degré de mosaïsme tumoral, aussi bien dans les tumeurs solides que dans les hémopathies malignes.
COMMENT EXPLIQUER CETTE HÉTÉROGÉNÉITÉ
Le modèle darwinien de développement d’un cancer
Dans cette hypothèse, un cancer a pour origine une cellule unique qui est la cible de mutation(s) qui l’affranchissent des mécanismes physiologiques limitant sa prolifération. Par la suite, une succession de mutations conférant un avantage sélectif suivie de périodes d’expansion clonale, aboutit à la formation d’une tumeur maligne.
La masse tumorale est alors un ensemble dynamique de plusieurs populations de cellules en voie de transformation ou déjà transformées, dont une population numériquement majoritaire correspondant à celle en phase de dominance clonale. Chacune de ces populations, y compris les métastases, représente une des différentes étapes de la formation d’un cancer et il existe un lien phylogénétique entre elles puisque les cellules qui les composent ont en commun les mêmes mutations causales. Ces mutations qui contribuent au développement néoplasique sont appelées drivers pour les différencier des mutations dites passengers qui sont générées au cours de la progression tumorale, mais dont la présence ne confère pas d’avantage sélectif
L’implication de cellules souches cancéreuses
Afin de rendre compte de cette diversité intratumorale, cette hypothèse présuppose l’implication des cellules souches cancéreuses dont la capacité à donner naissance à différents types cellulaires contribuerait à l’hétérogénéité phénotypique d’une même tumeur.
ACTUELLEMENT...
On peut considérer une tumeur comme un écosystème constitué de plusieurs sous-populations de cellules malignes avec leur architecture génétique spécifique et évoluant dans des niches géographiques distinctes tout en entretenant des relations complexes de compétition et de mutualisme....
En résumé, l'évolution de la maladie
| Initiation | Promotion | Progression | Métastases |
|---|---|---|---|
|
|
|
|
|
|
|
|
La tumeur peut entraîner des signes ou des symptômes par différents mécanismes...
- Par un effet dit de « masse » entraînant une distension souvent douloureuse de la capsule entourant, par exemple, le rein ou le foie
- Par une obstruction d'un canal par compression qui peut se traduire, par exemple, par une jaunisse, ou ictère, lorsqu’un cancer du pancréas comprime le canal cholédoque, assurant le drainage de la bile.
- Une effraction d'un canal qui peut déclencher une hémorragie et se traduire, par exemple, par la présence de sang dans les urines, ou hématurie. Ceci peut se voir en cas d’envahissement des cavités excrétrices du rein par un cancer rein
- Un envahissement d'un plexus nerveux va se traduire par des douleurs. Ceci est le cas, au décours d’un cancer du pancréas lorsque la maladie envahit le plexus cœliaque.
Mise à jour
27 octobre 2020

