Les cancers non à petites cellules
Rappel des définitions
-
Un micronodule est une lésion globalement sphérique de moins de 5 mm
-
Un nodule est une lésion mesurant entre 6 mm et 3 cm
-
Une masse est une lésion mesurant au moins 3 cm
Le cancer du poumon (bronchique) de type épidermoïde
HABITUELLEMENT...
C’est un cancer qui prend naissance, dans les grosses bronches (bronches lobaires ou segmentaires), souvent près d’une bifurcation. Il représente encore près du tiers des cancers non à petites cellules. Il est plus répandu chez les hommes.
Au début, il est situé sur la paroi interne de la bronche et se présente sous forme d'une tumeur végétante de taille variable visible en endoscopie bronchique. La tumeur peut assez rapidement obstruer la bronche et être à l'origine d’infections respiratoires comme des pneumonies. Il s'étend, au début, généralement lentement.
Les symptômes révélateurs les plus communs sont les expectorations de sang ou hémoptysies, causées par l'irritation de la paroi interne des bronches et des infections respiratoires à répétition.
Ils tendent à reproduire la structure d’un épithélium malpighien*. En immunohistochimie, ces cancers sont positifs pour un marquage par p40.
DES VARIANTES
Les anatomopathologistes décrivent trois variantes de la maladie selon l'aspect des cellules au microscope : les formes kératinisantes, non-kératinisantes et les formes basaloïdes.
* L'épithélium est composé de cellules accolées et solidaires entre elles grâce à des systèmes de jonction, réparties en un ou plusieurs feuillets. Elles reposent sur une lame basale qui les sépare du tissu conjonctif. Les épithéliums malpighiens sont faits de cellules pavimenteuses et peuvent être kératinisés (épiderme) ou non kératinisés, comme l'intérieur des bronches.
Les adénocarcinomes (ADC)
LES PLUS COMMUNS MAINTENANT...
Ils représentent maintenant plus du tiers des cancers non à petites cellules et leur incidence est en augmentation constante depuis une décennie. C'est le type de cancer du poumon le plus commun chez la femme et chez les non-fumeurs.
L'adénocarcinome se développe dans les zones périphériques du poumon, en particulier au niveau des lobes supérieurs et près de la plèvre.
La prolifération tumorale se fait à partir des glandes muqueuses situées sur la surface extérieure du poumon.
Les adénocarcinomes peuvent varier à la fois par leur taille et par leur rapidité de développement.
En immunohistochimie, ces cancers sont positifs pour un marquage par le Thyroid Transcription Factor-1 (TTF1).
Il sont parfois associés à une addiction oncogénique*, comme en cas d'une mutation d’EGFR (10 % des cas), d'un réarrangement de ALK** (5 % des cas) ou un réarrangement de ROS1*** (1 % des cas).
PLUS PRÉCISÉMENT...
Au moins deux variantes...
Il existe deux principales variantes sur le plan histologique, l’adénocarcinome acineux et l'adénocarcinome papillaire.
Trois mécanismes caractérisent ce cancer...
Le premier est une mutation activatrice de gènes de récepteurs de facteurs de croissance (EGFR, HER2) et des voies de signalisation KRAS/BRAF/MEK et PIK3CA/AKT/mTOR.
Le deuxième consiste en une translocations des gènes ALK, ROS1, et RET.
Le troisième est sous-tendu par des amplifications de gènes ou une surexpression de protéines membranaires (MET).
* l'addiction oncogénique est un phénomène survenant lorsque la survie d'une cellule cancéreuse est totalement dépendante de l'activation continuelle d'une voie de signalisation cellulaire. L'inactivation de cette voie de signalisation entraîne alors la mort cellulaire par apoptose. Ceci est le mode d'action de certaines thérapies ciblées.
** Le gène ALK (de l’anglais Anaplasic Lymphoma Kinase), physiologiquement permet l’expression d’une protéine qui est normalement exprimée dans le cerveau où elle joue un rôle important dans le développement neuronal. Des altérations au niveau de ce gène vont amener à l’expression d’une protéine anormale, notamment dans les poumons, occasionnant un dysfonctionnement de la cellule.
*** Le gène ROS1 normal est responsable de la production d'une protéine responsable des signaux dans les cellules et leur processus de croissance. Un cancer du poumon non à petites cellules qui présente une mutation dans ce gène est dit ROS1 positif (ROS1+). Il produit une protéine défectueuse responsable de la cancérisation des cellules.
Cancers du poumons chez les non-fumeurs
L'incidence mondiale du cancer du poumon diminue parallèlement à la baisse des taux de tabagisme dans les pays développés, néanmoins l'incidence du cancer du poumon chez les personnes qui n'ont jamais fumé (LCINS) est stable ou en augmentation.
Cet forme de cancer du poumon représente la huitième cause de mortalité liée au cancer aux États-Unis et la cinquième cause au niveau mondial. Ce type de cancer présente des spécificités histologiques et épidémiologiques par rapport aux cancers du poumon liés au tabagisme :
- Il s'agit presque exclusivement d'adénocarcinomes
- Il affecte le plus souvent les femmes et les personnes d'ascendance asiatique.
Ce type de cancer est associé à de fréquentes altérations oncogéniques pouvant représenter une cible pour les biothérapies : EGFR dans plus 60% des cas, ALK, 15% des cas ou KRAS 10%, A l'opposé, ils possèdent une faible charge mutationnelle tumorale et de faibles taux de positivité-L1, ce qui les rend peut accessibles à l'immunothérapie ciblée..
Leur développement implique probablement des interactions entre le risque génétique, médié par des variantes germinales communes et rares, et les expositions environnementales, y compris la pollution de l'air et les particules.
Association entre le type d’altération génétique et le sous-type d’adénocarcinome pulmonaire
| Type de mutation | Sous-type histologique altération d’adénocarcinome |
|---|---|
| EGFR | Bien différencié, avec composante bronchioloalvéolaire non mucineuse, papillaire et/ou micro- papillaire |
| KRAS | Bronchioloalvéolaire ou non, de type mucineux |
| ELM4-ALK | De type solide et/ou avec composante à cellules isolées |
| ROS1 | |
| CNNB1 | A cellules claires (bêtacaténine) ou de type fœtal |
ANCIENNEMENT LE CANCER BRONCHIOLO-ALVÉOLAIRE
LA CLASSIFICATION OMS DE 2015
Le carcinome bronchiolo-alvéolaire est dorénavant dénommé : adénocarcinome in situ et adénocarcinome avec invasion minime.
Les adénocarcinomes infiltrants sont classés en fonction de leur architecture prédominante avec 3 grades pronostiques : tubuleux, papillaire, lépidique ; HG: solide, micropapillaire, mucineux.
UNE FORME RARE PARTICULIÈRE...
C’est 5 % des cas, de cancer du poumon mais son incidence est en constante augmentation. Elle touche à égalité l’homme et la femme.
Il correspond à un adénocarcinome pulmonaire primitif développé aux dépens des cellules de l’unité respiratoire terminale. La croissance est lépidique (respect de l'architecture pulmonaire et une prolifération le long des parois alvéolaires) sans invasion stromale, vasculaire ou pleurale.
Étant non infiltrant, il peut donc être considéré comme un cancer in situ. De plus, il présente les particularités suivantes :
- Son lien avec le tabagisme n’est pas établi
- Son évolution clinique est lente en raison d'un temps de doublement très long
- Son extension ganglionnaire et métastatique est rare
- Son traitement est spécifique par les inhibiteurs de la tyrosine kinase associée au récepteur du facteur de croissance épidermique EGFR
DEUX VARIANTES
A partir des résultats des radiographies pulmonaires, les spécialistes identifient deux formes distinctes de la maladie :
- La forme localisée se présente sous la forme d’un nodule périphérique et un raccordement pleural dont la prise en charge précoce est associée à un excellent pronostic
- La forme étendue évolue de proche en proche vers la confluence jusqu’à la devenir bilatérale
Les formes rares de la maladie
LE CARCINOME NEURO-ENDOCRINE À GRANDES CELLULES
Cette forme représente environ 10 % des cancers non à petites cellules. Son incidence est en forte augmentation.
Il se développe près de la surface extérieure des poumons.
Ce type de tumeur peut évoluer rapidement car la maladie est souvent étendue, au moment du diagnostic, au médiastin, à la plèvre, aux os ou au cerveau.
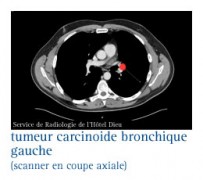
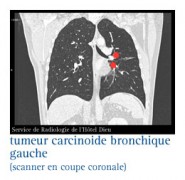
LES AUTRES FORMES RARES
Elles représentent moins de 10 % de l’ensemble des cancers du poumon. Les spécialistes décrivent, à partir des observations au microscope, des tumeurs carcinoïdes, des cylindromes ou des tumeurs muco-épidermoïdes.
La stadification
C'EST UNE ÉTAPE ESSENTIELLE POUR DETERMINER LA STRATEGIE THERAPEUTIQUE...
Elle commande la stratégie thérapeutique. Si la maladie est localisée le traitement principal sera la chirurgie. Si la maladie est étendue, le traitement principal sera, alors, la chimiothérapie, l'immunothérapie et/ou la radiothérapie.
PRINCIPE DE LA CLASSIFICATION T.N.M.
Une classification du stade ou stadification est un code standard international par lequel les équipes de cancérologie décrivent l'extension d'un cancer. Le système appliqué est le système TNM de l' American Joint Committee on Cancer.
Les caractéristiques, T, N, M, attribuées au cancer, peuvent être regroupés en un petit nombre de stades.
Les stades sont exprimés par un chiffre romain allant de 0, le moins avancé à IV, le plus avancé. Le système TNM se subdivise en deux :
- La stadification clinique pré thérapeutique (avant le traitement), désignée par TNM ou cTNM (c indiquant que le stade a été déterminé par l’examen clinique)
- La stadification anatomo-pathologique et post-chirurgicale désignée par pTNM (p indique que le stade a été donné par l’examen au microscope de la tumeur). L’estimation du pronostic est meilleure avec le pTNM qu’avec le cTNM.
PRÉCISER AU MIEUX LE STADE...
La détermination de la valeur de T
Elle est capitale pour préciser le stade d’évolution de la maladie et pour déterminer la stratégie thérapeutique à mettre en œuvre pour traiter la maladie.
La détermination de la valeur de "N"
Selon la taille des ganglions examinés au scanner, le médecin peut recommander un examen supplémentaire appelé médiatinoscopie. C'est une intervention mineure destinée à examiner les ganglions lymphatiques dans le thorax et à effectuer une biopsie. La médiatinoscopie permet de déterminer si les ganglions sont réellement cancéreux ou s'ils sont se sont développés à cause de l'inflammation associée au cancer. Elle permet ou non de confirmer le stade de la maladie.
La qualité de la résection "R"
Les sociétés savantes ont défini la valeur de "R"
- R0 : Marges vasculaires, bronchiques, périphérie des structures réséquées en bloc histologiquement saines
- R1 : Marges histologiquement non saines - Cytologie d’un épanchement pleural ou péricardique positive
- R2 : Résidus tumoraux ou ganglionnaires
T.N.M.
| TUMEUR = T | GANGLION = N (Node) | Métastase = M |
|---|---|---|
|
|
|
La stadification T.N.M. (8ème édition IASLC 2015, UICC 2017)
| Stade | Tumeur (T) | Ganglions régionaux (N) | Métastase(s) (M) |
|---|---|---|---|
| 0 | Tis | N0 | M0 |
| IA-1 IA-2 IA3 IB |
T1a T1b T1c T2a |
||
| IIA | T2b | ||
| IIB | T3 T1 ou T2 |
N0 N1 |
|
| IIIA | T1 ou T2 T4 T3 ou T4 |
N2 N0 N1 |
|
| IIIB | T3 ou T4 T1 ou T2 |
N2 N3 |
|
| IIIC | T3 ou T4 | N3 | |
|
IVA |
Tout T | Tout N |
M1a |
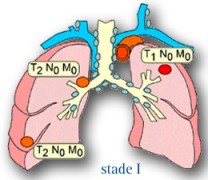
Les stades localisés : I et IIa
LES STADES I
C'est le stade le moins avancé de la maladie qui ne s'est pas étendue aux ganglions lymphatiques, N0 et il n’y a pas de métastases viscérales, M0. Le Stade I est lui-même sous divisé en deux :
- Au stade Ia, la maladie T1 est confinée à un segment du poumon
- Au stade Ib, la tumeur est toujours localisée dans un segment du poumon mais elle est plus grosse, T2
Le traitement chirurgical de la tumeur soigne la plupart des patients avec succès.
Cependant, très peu de patients sont diagnostiqués à ce stade car les symptômes ne sont pas assez prononcés pour que, l'on puisse suspecter un cancer.
LE STADE IIa
La maladie est encore localisée. Le cancer est limité à un segment du poumon, mais il s’est étendu aux ganglions lymphatiques avoisinants (ganglions péri bronchiques ou hilaires homolatéraux, y compris par extension directe) d’où N1. Ceci correspondant à la formule, T1N1M0.
Les cancers localement avancés mais opérables
LE STADE IIb
A partir de ce stade, la maladie est dite localement avancée . Cette qualification a d’importantes implications quant à la conduite du traitement. Ceci explique que l’équipe médicale pourra multiplier les examens complémentaires pour acquérir une certitude quant à l’extension de la maladie.
Le cancer est alors présent dans les ganglions lymphatiques (N+) situés dans le médiastin (espace au milieu du thorax, hors des poumons).
La maladie est toujours limitée à un segment du poumon mais la tumeur est plus grosse (T2 ou T3).
Les ganglions lymphatiques avoisinants peuvent être touchés ou non. Ceci correspondant aux deux formules de stadification : T2N1M0 ou T3N0M0.
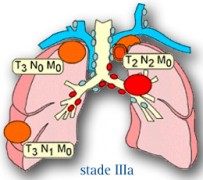
LE STADE IIIa
Le cancer est associé à une atteinte plus ou moins importante des ganglions lymphatiques. Ceci correspondant à deux formules différentes : T1 à T3 N2M0 ou T3N1M0.
Les cancers étendus et/ou métastatiques
STADE IIIB
Le cancer est dit localement avancé. Il s'est étendu à plus d'un site. Le nombre de ganglions est plus élevé et ils sont plus disséminés. Ce stade correspond à deux formules différentes : T1 à T4N3M0 ou T4N1 à N3M0.
LE STADE IV (métastatique)
C'est le plus avancé des cancers du poumon. Il s'est étendu à des parties du corps distantes et a formé des métastases. Cela correspond à la formule de stadification : Tout T, Tout N, M1. Les métastases (M1) peuvent être...
- M1a : dans l'autre poumon ou à la plèvre entraînant une pleurésie (épanchement pleural) ou au péricarde (membrane entourant le cœur)
- M1b : dans d'autres organes comme le foie, les os, le cerveau, la surrénale et plus rarement dans d’autres organes
Au delà de la stadification, les autres paramètres à prendre en compte...
LE GRADE HISTOLOGIQUE
Le principe
Les tissus prélevés lors de la biopsie ou de l'intervention chirurgicale sont examinés par le médecin anatomopathologiste au microscope (examen histologique) qui leur attribue un grade pathologique.
Le grade pathologique aide à préciser la stratégie thérapeutique et d'évaluer le pronostic de la maladie.
Plus les tumeurs sont indifférenciées, c’est à dire différentes des structures normales, plus elles sont agressives. A l'inverse, en général, plus une tumeur est différenciée, c’est à dire proche de la structure normale, plus son évolution est favorable.
Les différents grades
La lettre G suivie d'un chiffre allant de 1 à 4 (X voulant dire que le grade ne peut pas être précisé) indique l’aspect histologique de la tumeur. Ce type de gradation est utilisé pour les cancers invasifs mais pas pour les cancers in situ.
Les tumeurs sont parfois désignées comme étant bien différenciées, modérément différenciées ou peu différenciées.
Par exemple, les cancers G1 (grade 1) ont des cellules dont l'aspect est relativement normal. Les cellules se multiplient peu (faible nombre de mitoses). Les cancers G4, le grade le plus haut, ont des cellules très indifférenciées, un nombre de mitoses est élevé. De nombreuses cellules présentent des anomalies des noyaux cellulaires (ploïdie).
Les cancers G2 ou G3 ont des caractéristiques intermédiaires entre les grades 1 et 4.
LA PLOÏDIE
La ploïdie des cellules cancéreuses se réfère à la quantité d'ADN qu'elles contiennent dans leur noyau. S'il y a une quantité normale d'ADN, les cellules sont dites diploïdes. Si le taux d'ADN est anormal, les cellules sont dites aneuploïdes.
Certaines études ont montré que les cancers aneuploïdes ont tendance à être plus agressifs.
Le pourcentage de phase S pourrait avoir un intérêt pronostic dans certaines formes de la maladie.
L’INDEX Ki-67
L’antigène Ki-67 ( Ki = étude réalisée, à l'origine dans la ville de Kiel sur un clone de cellules 67) est un marqueur de prolifération .
Il est présent au niveau du noyau des cellules prolifératives, en phase G1, S, G2 et M. Sa fonction précise n'est pas connue mais sa participation au maintien du pouvoir prolifératif tumoral ou au contrôle du cycle cellulaire est suggérée.
L’antigène Ki-67 est détecté par anticorps Ki-67 en immunohistochimie et immunofluorescence. L’index de marquage par le Ki-67 représente le pourcentage de noyaux colorés par l’anticorps Ki-67.
Un index Ki-67 élevé indique que les cellules cancéreuses se divisent rapidement. Cet indice a peu d'intérêt en pratique dans le cancer du poumon pour évaluer le pronostic de la maladie.
La recherche des mutations, une étape devenue essentielle...
LES RÉSULTATS OBTENUS PAR L' IFCT
Une mutation oncogénique est présente dans plus de la moitié des cas, dans une étude portant sur 17 664 patients présentant un cancer du poumon non à petites cellules (The Lancet 2017;389(10066):299-311). Une mutation était légèrement plus fréquente en cas d'un adénocarcinome. Il s’agissait d’une mutation de :
- EGFR dans 10 % des cas
- HER2 dans 2 % des cas
- KRAS dans 29 % des cas
- BRAF dans 2 % des cas
- PIK3CA dans 2 % des cas
- ROS1 dans 2 % des cas
- Réarrangement ALK dans 5 à 7 % des cas
Ces mutations sont, dans plus de 90 % des cas, mutuellement exclusives.
C'EST DEVENU UN EXAMEN STANDARD
L'étude des anomalies moléculaires, à partir des fragments de la tumeur, devient un point important pour définir la stratégie thérapeutique car elle conditionne l'utilisation de certaines thérapies ciblées. Sa connaissance a, par ailleurs, des implications en matière de pronostic.
Une recherche d’altérations moléculaires doit systématiquement être demandée si suffisamment de tissu a pu être obtenu pour le diagnostic, en cas de cancer non épidermoïde de stade avancé pour déterminer la conduite thérapeutique ou face à un cancer épidermoïde de stade avancé chez les non-fumeurs, dans la même optique
La recherche d’altérations moléculaires doit être effectuée au maximum dans les 3 semaines suivant la date de prélèvement de telle façon de disposer des résultats de certaines altérations avant de débuter la 1ère ligne de traitement (particulièrement EGFR, ALK et ROS1 chez les non-fumeurs). D’autres altérations peuvent attendre la seconde ligne.
Quelques exemples de mutations...
CELLES AFFECTANT LE FACTEUR ÉPIDERMIQUE DE CROISSANCE (EGFR)
Le facteur de croissance épidermique et son récepteur, EGFR sont surexprimés dans environ 15 % des adénocarcinomes, Dans ce cas la croissance de la tumeur est sous sa dépendance; On parle d'addiction. Ils peuvent aussi être mutés.
Maintenant, la recherche de mutations somatiques de l'EGFR est nécessaire, en particulier, s'il s'agit d'un cancer non épidermoïde, si vous êtes non fumeur et si l'on envisage un traitement par un médicament ciblé bloquant l’EGFR comme le Tarceva™ ou l'Iressa™.
Le HER2/neu
Plus rarement (< 5 %), un taux trop élevé d'une protéine accélératrice de la croissance, appelée HER2/neu, est mis en évidence à la surface des cellules tumorales. Ces cancers ont tendance à se développer et à s'étendre plus agressivement. Son expression serait prédictive de la réponse aux médicaments inhibiteurs du récepteur du facteur de croissance épidermique.
LA RECHERCHE D'AUTRES MUTATIONS
Les recommandations actuelles
La recherche de mutation EML4-ALK observée dans environ 5 % des cas de cancers non épidermoïdes, plutôt chez les sujets jeunes, devient de plus en plus systématique car il existe des traitement ciblant cette protéine.
Les équipes recherchent maintenant de plus en plus souvent les mutations somatiques affectant les gènes KRAS (non G12C 12 % ou G12C 12 %), BRAF (5 %) et PIK3CA car, en cas de mutations ou d'addiction, il existe maintenant des traitement spécifiques.
Une recherche de l’expression de PDL1 en immunohistochimie sur les cellules tumorales est nécessaire pour tous les carcinomes non à petites cellules pour les stades IIIA non résécables à IV si on envisage une immunothérapie.
A l'avenir...
Plusieurs autres marqueurs biologiques permettant de préciser la sensibilité de la tumeur au traitement ont été récemment individualisés et sont, pour la plupart, en cours de validation par la recherche clinique.
- La bêta-tubuline définirait une meilleure sensibilité aux traitements à base de taxanes, comme le Taxol™ ou le Taxotère™
- L'expression de l' ERCC1 (endonuclease of the nucleotide repair complex) serait en faveur d'un traitement à base de platine
- Le présence du gène non muté K-ras (Kirsten-Rous sarcoma virus) serait prédictif de la réponse aux médicaments inhibiteurs du récepteur du facteur de croissance épidermique(EGFR)
- La surexpression du gène RRM1 qui encode la sous-unité régulant la ribonucléotide réductase serait prédictif d'une activité de la gemcitabine
- Une mutation du PI3K ou du LKB1, une amplification du ME T chez 4 % des patients qui sont généralement jeunes et non-fumeur.
Quelques exemples de mutations associées à des traitements spécifiques
| Anomalie génétique | Mutations activatrice de l'EGFR | Mutation du KRAS | Translocation EML4-AKL |
|---|---|---|---|
| Valeur prédictive | Réponse supérieure aux traitements par des inhibiteurs de l'EGF par rapport à la chimiothérapie en 1ère ligne |
Réponse faible aux inhibiteurs de tyrosine kinase | Traitements spécifiques de la translocation |
| Recherche | Systématique pour la décision thérapeutique | Avant la 1ère ligne | Recherche de routine prochainement |
Mise à jour
16 mars 2024

