L'immunothérapie
Rendre visible la tumeur au système immunitaire...
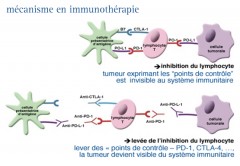
L'immunothérapie a pour objectif de rétablir une réponse immunitaire efficace permettant au système immunitaire de reconnaitre et de s’attaquer aux éléments anormaux ou étrangers à l’organisme. Pour cela, l'immunothérapie va agir sur des perturbations qui interviennent dans les cellules tumorales ou leur environnement. De fait, la tumeur a la capacité de « freiner » le système immunitaire (immuno-éditing) et de le rendre inefficace et permettre à la maladie de progresser.
De ce fait, les inhibiteurs des points de contrôle "lèvent ces freins" et "déverrouillent" le système immunitaire !
PD1 & PD-L1 (programmed cell death protein 1)
BIOLOGIQUEMENT...
La voie du programmed cell death protein 1 (PD1) est un rétrocontrôle "négatif* est impliqué dans le processus d’activation des lymphocytes, au niveau des tissus périphériques et du microenvironnement tumoral.
Alors que le CTLA4, autre point de contrôle du système immunitaire, régule l’activation précoce du lymphocyte "T naïf "dans le ganglion lymphatique, le récepteur PD1 active le lymphocyte T lors de sa phase effectrice au contact des celules de la tumeur.
Le PD1 est exprimé au niveau des lymphocytes "T" CD4+ (helper - auxiliaires) et CD8+ (cytotoxiques) et des lymphocytes Treg (régulateurs/suppresseurs).
Le récepteur PD1 possède deux ligands, le PD-L1 (ou B7-H1) et le PD-L2 (ou B7-DC).
BLOQUER CETTE VOIE DE SIGNALISATION...
De nombreux travaux ont démontré que la voie PD1/PD-L1 est souvent utilisée par les tumeurs pour échapper au système immunitaire, le rendant inopérant pour éliminer les cellules tumorales qui expriment souvent le ligand PD-L1 à leur surface.
Quand le récepteur et son ligand sont liés, la réponse antitumorale des lymphocytes T est fortement diminuée. Il se crée alors une sorte de bouclier, “rendant invisible” la cellule cancéreuse au système immunitaire du patient. De plus, cette liaison provoque ce qui a été appelé ‟T cell exhaustion”, c'est à dire l’épuisement fonctionnel des lymphocytes T…
Quand il y a blocage de cette liaison par un médicament de ce point de contrôle, ceci permet au système immunitaire de reconnaître de nouveau les cellules cancéreuses et ainsi de les détruire.
En fait, les nouvelles immunothérapies anti-PD-1 et anti-PDL-1 interagissent, non seulement avec lymphocytes T mais, aussi, avec les lymphocytes B et les cellules "tueuses" NK.
*Un système de rétroaction utilise l'un des produits d'une voie, d'ordinaire le produit final, pour contrôler l'activité de la voie et à réguler la quantité de ce produit. Le contrôle par rétroaction peut être positif ou négatif.
Les inhibiteurs de check-point immunologique (ICP)
Contrairement aux thérapies conventionnelles dont le but est de détruire directement les cellules cancéreuses,
les nouvelles immunothérapies, tels que les inhibiteurs des points de contrôles immunitaires "checkpoints",
agissent en stimulant le système immunitaire de l’hôte pour qu’il puisse
détecter, reconnaître et enfin détruire les cellules malignes.
Le principe du traitement est d’augmenter l’immunité cellulaire antitumorale en levant l’inhibition frappant les lymphocytes T.
LES ANTI-PD-1
Un anticorps monoclonal dirigé contre le PD-1.
Utilisé dans le traitement des cancers bronchiques de type épidermoïde ou non, ce médicament augmente significativement le taux de survie et le temps sans rechute par rapport au traitement de référence, le docétaxel.
De plus, récemment, une étude a montré l'intérêt de de cette approche thérapeutique en traitement néo-adjuvant (avant la chirurgie). D'autres études sont en cours pour juger l'intérêt de cette approche pour le traitement des cancers du poumon à petites cellules.
Son statut
Il est homologué pour le traitement du cancer bronchique non à petites cellules (CBNPC)
- Avec métastases en association à l’ipilimumab et à 2 cycles de chimiothérapie à base de sels de platine, en première ligne dont les tumeurs ne présentent pas la mutation sensibilisante de l’EGFR, ni la translocation ALK.
- Localement avancé ou métastatique après une chimiothérapie antérieure.
- Résécable à haut risque de récidive, dont les tumeurs expriment PD-L1 au seuil ≥ 1 %
- En traitement néoadjuvant en association à une chimiothérapie à base de sels de platine
La dose recommandée est soit de 240 mg de nivolumab toutes les 2 semaines, soit de 480 mg toutes les 4 semaines en perfusion intraveineuse.
Les effets secondaires les plus fréquents sont une lymphopénie, de la fatigue, et un taux de lipase augmenté. Les effets secondaires sévères sont de la diarrhée, des problèmes endocriniens et des hépatites.
LES ANTI-PDL-1
LE RATIONNEL
La protéine PDL-1, ligand du récepteur membranaire PD1, est exprimée dans 50% des cancer non à petites cellules du poumon (CBNPC) et représente, de ce fait, une cible thérapeutique intéressante.
C'est un anticorps monoclonal dirigé contre le ligand du récepteur PD1...
En seconde ligne, des études cliniques ont comparé ce médicament (2 et 10 mg/kg) au traitement "standard" par le docétaxel (75 mg/m²) chez des patients souffrant de cancers non à petites cellules surexprimant le ligand du récepteur PD1 (PD-L1) sur au moins 50 % des cellules tumorales (test pharmDx test PD-L1 IHC). Il appert que le pembrolizumab s'est montré supérieur au traitement standard en termes de survie globale et de temps sans progression de la maladie.
En première ligne, l'étude KEYNOTE-021 a montré un meilleur taux de réponse avec l’association chimiothérapie + pembrolizumab par rapport à l’utilisation de la chimiothérapie seule (différence de 26 % dans le taux de réponses).
Dans la deuxième essai KEYNOTE-024, le risque de progression de la maladie ou de décès est abaissé de 50 % chez les patients présentant un cancer non de type épidermoïde, traités par pembrolizumab par rapport à ceux pris en charge par chimiothérapie seule à base de platine.
Dans l'essai KEYNOTE 671, le pembrolizumab, donné en traitement néoadjuvant (4 cycles à trois semaines d'intervalles versus traitement par cisplatine) de cancers du poumons à un stade précoce suivie d'une immunothérapie post-chirurgicale, améliore significativement la survie sans progression.
Son statut
Ce médicament est homologué pour le traitement du cancer bronchique non à petites cellules (CBNPC)
- En monothérapie dans le traitement de première ligne dont les tumeurs expriment PD-L1 avec un score de proportion tumorale (TPS) > 50 %, sans mutations tumorales d’EGFR ou d’ALK.
- En association à une chimiothérapie pemetrexed et sel de platine dans le traitement de première ligne métastatique non-épidermoïde dont les tumeurs ne présentent pas de mutations d’EGFR ou d’ALK.
- En association au carboplatine et au paclitaxel ou au nab-paclitaxel dans le traitement de première ligne du cancer bronchique non à petites cellules métastatique épidermoïde.
- En monothérapie dans le traitement du cancer bronchique non à petites cellules localement avancé ou métastatique dont les tumeurs expriment PD-L1 avec un TPS > 1 %, et ayant reçu au moins une chimiothérapie antérieure. Les patients présentant des mutations tumorales d’EGFR ou d’ALK doivent avoir préalablement reçu une thérapie ciblée.
Il est administré sous forme d'une perfusion IV pendant 30 minutes toutes les 3 semaines. Le traitement doit être poursuivi jusqu'à confirmation de la progression de la maladie. La dose recommandée est de 200 mg en première ligne et de 2 mg/kg en seconde ligne.
C'est anticorps monoclonal bloquant le ligand PDL-1.
Les résultats de la recherche clinique ont montré de façon significative un bénéfice sur la survie globale en comparaison au traitement classique par le docétaxel. Le bénéfice sur la survie globale apparaît corrélée au niveau d’expression de PD-L1 sur les cellules tumorales ou immunitaires. Un statut" PDL-1 positif" augmente le taux de réponses. Dans ce cas, jusqu’à 100 % des cancers de type épidermoïdes peuvent répondre à ce traitement. Ces résultats ont été confirmés dans l'étude de OAK en termes de survie globale.
Ce médicament est homologué dans le traitement du cancer bronchique non à petites cellules localement avancé ou métastatique après une chimiothérapie antérieure (seconde ligne).
La dose recommandée est de 1200 mg administrée par voie intraveineuse toutes les trois semaines. Le traitement est poursuivi jusqu'à perte du bénéfice clinique ou survenue d'une toxicité inacceptable.
Sur le plan de la tolérance, à ce jour, il n’y a eu aucun cas d’atteinte pulmonaire, mais des cas de péricardite, d’asthénie, de diarrhée, de troubles métaboliques (hyponatrémie, hyperglycémie). Par ailleurs, les autres effets indésirables sont ceux de cette classe de médicaments.
Ce médicament appartient à cette classe. Il est indiqué dans le traitement du cancer du poumon non à petites cellules (CPNPC) localement avancé et non résécable, dont la maladie n'a pas progressé après chimio-radiothérapie à base de platine.
La dose recommandée est de 10 mg/kg, administrée en perfusion intraveineuse sur une période de 60 minutes toutes les 2 semaines jusqu'à progression de la maladie ou toxicité inacceptable.
Les effets indésirables sont ceux de cette classe de médicaments et sont présentés dans un chapitre spécifique de ce site.
Les indications officielles en France
|
|
|
| Contre-indications | ||
|
||
Les dernières recommandations...
| Types de cancer du poumon | Recommandations |
|---|---|
| Épidermoïde ou non Sans biomarqueurs positifs |
|
| Avec surexpression du PD-L1 |
|
| Sans surexpression de PD-L1 ou de statut inconnu |
|
| Avec mutation activatrice de l’EGFR et une progression de la maladie après un traitement de première intention par inhibiteur d'EGFR |
|
| Avec un réarrangement du gène ROS1 |
|
Mise à jour
27 novembre 2023

