Les points de contrôles immunologiques
L'attaque de la cellule tumorale par le système immunitaire....
Première étape : libération des antigènes
La cellule cancéreuse libère dans sont environnement des protéines étrangères, les antigènes tumoraux.
⇓
Deuxième étape : "présentation" des antigènes
A l'intérieur des ganglions lymphatiques, les lymphocytes T, reconnaissent les antigènes tumoraux
⇓
Troisième étape : activation des lymphocytes
Les antigènes activent les lymphocytes T dans les ganglions lymphatiques
⇓.
Quatrième étape : migration des lymphocytes
Les lymphocytes T migrent dans les vaisseaux sanguins vers la périphérie de la tumeur.
⇓
Cinquième étape : infiltration des lymphocytes dans la tumeur
⇓
Sixième étape : fixation aux cellules de la tumeur
Une fois dans la tumeur, les lymphocytes se lient aux cellules cancéreuses
⇓
Septième étape : destruction des cellules cancéreuses
Principaux mécanismes d’échappement tumoral
UNE RÉPONSE IMMUNITAIRE VARIABLE...
Globalement, deux types de réponses immunitaires dans les cancers sont possibles :
|
ANTI-TUMEUR |
PRO-TUMEUR |
|---|---|
| Tumeur précoce Immuno- surveillance |
Tumeur avancée Immuno- échappement Subversion |
LA TOLÉRANCE IMMUNITAIRE
La tumeur et son environnement sont capables de conduire à l'ignorance, par le système immunitaire de la tumeur. C'est ce que l'on appelle, la tolérance... De fait le système immunitaire "tolère" la tumeur...
La tumeur, dans ce cas, induit une anergie (absence de réaction immunitaire) et/ou un épuisement des lymphocytes infiltrant la tumeur (TIL) qui sont alors incapables de réagir à un stimulus antigénique ou simplement activateur.
POURQUOI ?
Au niveau des cellules tumorales
- Une faible immunogénicité des cellules tumorale est souvent en relation de la perte des molécules du complexe d'immunitaire cellulaire CMH-I, ce qui rend les cellules invisibles pour le système immunitaire
- Une modulation antigénique
- Une résistance à la lyse de la cellule tumorale
Au niveau des cellules immunitaires
- La mise en œuvre des mécanismes d'immunosuppression du fait de certaines sous-familles de lymphocytes, comme les lymphocytes Th2, les Treg, ou du fait des cellules myéloïdes suppressives, des macrophages M2, ainsi que des médiateurs solubles inhibiteurs, comme la prostaglandine PGE2, l'IL10 ou le TGFβ.
- Un épuisement secondaire des lymphocytes T faisant intervenir le molécules de point de contrôle immunitaire négatif, ICPi)
Les trois principaux obstacles de l’immunothérapie en oncologie...
| Le système immunitaire | Les cellules tumorales | La « prise en otage » des points de contrôle immunitaire |
|---|---|---|
|
Moduler la réponse immunitaire |
Tirent parti de cette réponse la possibilité de se dissimuler par rapport au système immunitaire par des mécanismes d’évasion immunitaire mis en œuvre pour éviter l’auto-immunité. | Nécessaire à l’activation des lymphocytes T Ils deviennent "aveugles" |
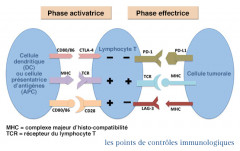
Les points de contrôle (check-points) immunitaires…
BIOLOGIQUEMENT
Ce sont des récepteurs impliqués dans la modulation de l’activation des cellules immunitaires dont la finalité est de limiter la durée et l’intensité de la réaction immune pour éviter des phénomènes d'auto-immunité.
A la surface d’une même cellule des récepteurs ont peut retrouver des récepteurs activateurs ou inhibiteurs, par exemple, les co-activateurs (renforcent l’activation) : Glucocorticoid-induced TNF receptor, OX40 (CD134), TNFRSF4et, à l'inverse, les co-inhibiteurs (diminuent l’activation) : CTLA-4, PD-1, LAG3, Lymph. T Ig mucin-3
C’est l’équilibre entre les signaux activateurs et les signaux inhibiteurs qui détermine si une cellule immunitaire peut s’activer.
Lorsqu'un lymphocyte T reconnaît son antigène spécifique grâce à son récepteur antigénique (TCR), il ne pourra être activé que si les différents signaux envoyés par ses points de contrôles sont en faveur d’une activation.
DES SYSTÈMES RÉGULATEURS FINS
Ces système régulateurs sont physiologiquement très importants...
Ils sont mis en œuvre pour prévenir le risque auto-immunité. Dans ce cas ce sont les récepteurs inhibiteurs qui sont activés.
Dans d'autres circonstances, ils sont activés pour renforcer l’activation du système immunitaire en cas d’infection par exemple. Dans ce cas, ce sont les récepteurs activateurs qui sont mis en œuvre.
Limiter la réponse avant qu'elle ne soit délétère...
Ces systèmes permettent, aussi, de prévenir une réaction excessive du système immunitaire. Par exemple, lorsqu’une réponse immunitaire a lieu, les signaux inflammatoires libérés dans le micro-environnement vont favoriser l’expression de ligands des récepteurs inhibiteurs par les cellules à proximité afin d’éviter un emballement de la réaction immune.
Les cellules tumorales contournent les points de contrôle...
Les cellules cancéreuses sont capables de détourner le système des check-points à leur avantage en surexprimant à leur surface les ligands des récepteurs inhibiteurs pour échapper au système immunitaire grâce à deux mécanismes de résistance :
- Primaire, du fait de mutations, la cellule tumorale se met à exprimer naturellement les ligands inhibiteurs, comme par exemple le PD-L1,
- Secondaire qui se produit lorsque la tumeur est attaquée, la libération de cytokines inflammatoires (IFNγ) par les cellules immunes dans le micro environnement favorise l’expression de ligands inhibiteurs à la surface des cellules tumorales.
Pourquoi cibler les points de contrôle du système immunitaires ?
LEUR UTILITÉ
Ce sont des récepteurs qui interviennent dans la modulation de l’activation des cellules immunitaires afin de limiter la durée et l’intensité de la réaction immune.
Il existe à la surface d’une même cellule des récepteurs co-activateurs (qui renforcent l’activation) et des récepteurs co-inhibiteurs (qui diminuent l’activation).
METTRE LES FREINS
L'organisme met des "freins" pour empêcher les lymphocytes T cytotoxiques CD8+, en particulier, d’attaquer ses propres tissus...
Ces freins sont en fait des protéines comme, par exemple, le CTLA-4 ou le PD-1. Elles sont exprimées à la surface des lymphocytes, des cellules dendritiques (cellules présentatrices d'antigènes) ou certaines cellules tumorales.
Ces molécules, appelées check-points immunitaires
Elles sont capables d’orienter la réponse immunitaire soit vers une réponse efficace, entraînant la destruction des cellules cancéreuses, soit vers un silence immunologique permettant, ainsi, à la tumeur de croître.
La poignée de main maudite !
..."Les cellules cancéreuses
|
J. Allison et T. Honjo Prix Nobel de Physiologie ou Médecine en 2018
... "Leur découverte du traitement du cancer par inhibition de la régulation immunitaire négative"...

LE PD1 et LE PDL-1
LEUR DÉCOUVERTE
Le récepteur PD-1 (Programmed cell Death)
Il a été découvert par Tasaku Honjo en 1992. Il est retrouvé à la surface des lymphocytes T mais aussi des lymphocytes B, des monocytes et des cellules présentatrices d'antigènes (APC). C'est une molécule de costimulation exprimée par les lymphocytes T activés ; le PD-L1 est son ligand
Le PD-L1 (Programmed cell Death Ligand 1)
C'est le ligand qui, comme son nom l'indique, se lie au récepteur PD1 et inhibe la réaction immunitaire. Si le ligand PD-L1 est porté par la cellule tumorale, celle-ci inhibe la réaction immunitaire et peut ainsi devenir "invisible" au système immunitaire.
LEUR FONCTION
La liaison PD1/ PD-L1 déclenche un signal inhibant transitoirement ou définitivement les capacités cytotoxiques des lymphocytes T CD8+ (activité antitumorale). Il faut savoir que cette interaction PD1/PD-L1 est d’abord un mécanisme physiologique visant à réduire l’auto-immunité.
Lorsque PD-L1 est exprimé par les cellules tumorales, cette interaction leur permet d’échapper à la surveillance immunitaire en inhibant l’activation des lymphocytes T cytotoxiques. L'interaction entre le PD1 et son ligand PDL-1 rend la cellule tumorale "invisible" au système immunitaire, en désactivant (ou désarmant) le lymphocyte T.
Les cellules tumorales peuvent, elles aussi, surexprimer le ligand PD-L1 et/ou PD-L2 à leur surface et induire un état de tolérance immunitaire par inhibition de l’activation lymphocytaire.
LA PROTÉINE CTLA-4
SA DÉCOUVERTE
Elle fut découverte de nombreuses années auparavant par P. Golstein au Centre d’immunologie de Marseille-Luminy (CIML). C'est une glycoprotéine qui est présente de manière constitutive à la surface des lymphocytes T cytotoxiques (CD8+) activés et des lymphocytes T régulateurs (Treg).
SON RÔLE : UN FREIN !
Elle freine la réponse des cellules "T" et c'est un "interrupteur" maintenant inactifs les lymphocytes T...
Elle induit un signal d’inhibition de l’activité des lymphocytes T lorsqu’ils se fixent aux récepteurs membranaires (CD80 et CD87) présents à la surface des cellules présentatrices d’antigène (CPA) ou cellules dendritiques. Elle inhibe la production d'IL2 et arrête la progression du cycle cellulaire.
En résumé...
| Récepteur PD1 Programmed cell death 1 |
Ligands PD-L1 et PD-L2 (protéine) |
Interaction PD1 (lymphocyte T) – PDL1 (CPA) |
|---|---|---|
|
Protéine de surface cellulaire (transmembranaire) |
Exprimés en surface des cellules dendritiques (CPA), macrophages, lymphocytes T et B, cellules souches mésenchymateuses, etc.… |
Régulation négative de la réponse immune |
Mise à jour
4 mai 2020

