-
Thérapies ciblées (biothérapies)
- Les fondamentaux
- Les principes généraux
- Les kinases et leur inhibition
- Les voies de transduction
- Les facteurs de croissance cellulaire
- Les inhibiteurs des facteurs de croissance
- Les inhibiteurs de l'angiogenèse
- Les inhibiteurs des voies de transduction
- Les molécules pro-apoptose
- Les inhibiteurs de la PARP
- Les inhibiteurs du protéasome
- Les protéines de choc (HSP)
- La chromatine et son remodelage
- Les inhibiteurs du cycle cellulaire
- Les effets indésirables de cette classe
- Les marqueurs biologiques des thérapies ciblées
-
Chimiothérapie
- Les bases théoriques
- La mise en oeuvre
- Les médicaments
- Les effets indésirables
- Hormonothérapie
-
Thérapies ciblées (biothérapies)
- Les fondamentaux
- Les principes généraux
- Les kinases et leur inhibition
- Les voies de transduction
- Les facteurs de croissance cellulaire
- Les inhibiteurs des facteurs de croissance
- Les inhibiteurs de l'angiogenèse
- Les inhibiteurs des voies de transduction
- Les molécules pro-apoptose
- Les inhibiteurs de la PARP
- Les inhibiteurs du protéasome
- Les protéines de choc (HSP)
- La chromatine et son remodelage
- Les inhibiteurs du cycle cellulaire
- Les effets indésirables de cette classe
- Les marqueurs biologiques des thérapies ciblées
- Immunothérapie
- Les médicaments du cancer approuvés en 2023
Thérapies ciblées (biothérapies)
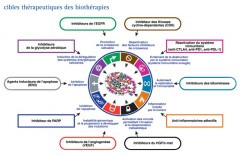
"THE HALLMARKS OF CANCER"
En 2000, dans un article publié dans la revue "Cells", dont le titre est "The hallmarks of cancer", que l’on peut traduire par "les capacités spécifique des cancers", D. Hanahan et R. Weinberg montrent que les cancers acquièrent six capacités distinctives que sont :
- L’autosuffisance en signaux de croissance,
- L’insensibilité aux signaux inhibiteurs de la croissance,
- La capacité à éviter l’apoptose,
- La capacité de se répliquer indéfiniment,
- L’induction de l’angiogenèse
- La capacité à former des métastases.
En 2011, dans un nouvel article "Hallmarks of cancer : The next generation ", ces mêmes auteurs mettent aussi en évidence deux caractéristiques favorisant les cancers, mais qui ne sont pas qualifiées de capacités distinctives : l’inflammation favorisant les tumeurs et l’instabilité et mutations du génome.
Grace à la découverte des oncogènes et des gènes suppresseurs de tumeurs, au progrès de la biologie moléculaire et au concept développé par Hanahan et Weinberg, le cancer apparaît comme une maladie de la signalisation. La tumeur possède un génome original qui s’exprime :
- Au niveau structural par analyse des gènes à travers :
- Mutations
- Délétions
- Amplification
- Translocation
- Au niveau fonctionnel par l’analyse des transcrits à travers :
- Surexpression
- Sous-expression
Maintenant plus de 50 petites molécules homologuées...
|
BM = biomarqueur |
||
|---|---|---|
| Afatinib BM Axitinib Osimertinib BM Bosutinib BM Cabozantinib Ceritinib BM Cobimetinib BM Crizotinib BM Dabrafenib BM Dasatinib BM Erlotinib BM Everolimus |
Gefitinib BM Ibrutinib Idelalisib Imatinib BM Lapatinib BM Lenvatinib Nilotinib BM Nintedanib Palbociclib Pazopanib Ponatinib BM |
Regorafenib Ruxolitinib Sonidégib Sorafenib Sunitinib Temsirolimus Trametinib BM Vandetanib Vemurafenib BM Vismodégib |
Nom = préfixe + sous-racine + racine
- tin : inhibiteur de tyrosine kinase
- zom : inhibiteur du protéasome (bortezomib, Velcade)
- cicl : inhibiteur des kinases dépendants des cyclines
- par : inhibiteur de PARP (olaparib)
- limus : activités dans les voies de signalisation m-Tor
Mise à jour
2024

